Гиперпластические процессы эндометрия: особенности пролиферативной активности при сочетании с хроническим эндометритом.
Шешукова Н.А., Макаров И.О., Овсянникова Т.В. Дата публикации на сайте: 2011-12-10 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Проведено комплексное патоморфологическое и иммуногистохимическое исследование соскобов эндометрия. При гиперпластическим процессе эндометрия и хроническом эндометрите отмечена высокая пролиферативная активность стромы желез (Кi-67), высокая экспрессия ТФР-β и СЭФР, что указывает на активно идущие процессы неоангиогенеза и нарушения во внеклеточном матриксе. Воспаление потенцирует пролиферативную активность эпителия и стромы гиперплазированного эндометрия, а значит, создает благоприятные условия для атипической трансформации клеток.
Ключевые слова: гиперпластические процессы эндометрия, хронический эндометрит, маркеры пролиферации, ТФР бета, СЭФР
ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России
Городская клиническая больница № 14 им. В.Г. Короленко департамента здравоохранения г. Москвы
Гиперпластические процессы эндометрия (ГПЭ), которые рассматриваются как основа для формирования рака эндометрия, продолжают оставаться актуальной проблемой в современной гинекологии [3,4,5].
Развитию ГПЭ способствуют множество разнообразных факторов и причин, среди которых наиболее часто выделяют гиперэстрогению, наличие эстроген-секретирующих опухолей яичников и ожирение [1,3].
Многие исследователи высказывают мнение о важной роли хронического воспаления эндометрия в развитии ГПЭ. Хронический эндометрит чаще является следствием перенесенного ранее острого воспаления. Факторами риска развития хронического эндометрита являются инфекционные процессы влагалища и шейки матки, использование внутриматочных контрацептивов, инвазивные внутриматочные вмешательства и др. [2].
Хронический эндометрит приводит не только к выраженным структурным и функциональным изменениям в ткани эндометрия, но и вызывает нарушение процессов пролиферации и секреторной трансформации эндометрия [2,4,6].
В этой связи, именно хронический воспалительный процесс может создавать оптимальные предпосылки не только для формирования пролиферативных процессов в эндометрии, но и для дальнейшей их атипической трансформации.
Целью настоящего исследования является определение частоты сочетания ГПЭ и хронического эндометрита и изучение пролиферативной активности клеток эндометрия при данных патологических состояниях на основании данных клинического, гистологического и иммуноморфологического методов исследования.
Материалы и методы исследования
В группу исследования вошли 320 пациенток, у которых по данным гистологического исследования ткани эндометрия, полученной при раздельном диагностическом выскабливании матки, был диагностирован гиперпластический процесс эндометрия.
Показаниями для госпитализации женщин в гинекологическое отделение ГКБ №14 явились: наличие эхографических признаков гиперплазии эндометрия (20,6%) и/или нарушение менструального цикла различного характера (79,4%).
Критериями включения женщин в исследование послужили: перименопаузальный период (средний возраст 48±2,9 г.), наличие гиперпластического процесса эндометрия без атипии, отсутствие онкологических заболеваний в анамнезе.
На основании результатов гистологического исследования материала из цервикального канала и эндометрия были отобраны пациентки и сформированы группы.
I группа – 204 женщины с простой гиперплазией эндометрия без атипии, II группа – 50 пациенток со сложной гиперплазией эндометрия без атипии, III группа – 66 женщин, у которых, по данным гистологического исследования, помимо гиперплазии эндометрия был диагностирован хронический эндометрит.
Комплексное обследование женщин включало сбор анамнеза, оценку соматического статуса, менструальной и репродуктивной функции, а также гистологические заключения о состоянии эндометрия (при наличии указаний в анамнезе о перенесенных ранее выскабливаниях матки).
Группы были сопоставимы по возрасту и паритету и тщательно подобраны с целью исключения влияния случайных факторов.
Морфологическое исследование проводили в Московском городском центре патологоанатомических исследований при Городской клинической больнице № 14 им. В.Г. Короленко департамента здравоохранения г. Москвы и кафедре патологической анатомии ГОУ ВПО «Московский государственный медико-стоматологический университет» Минздравсоцразвития России (руководитель центра и зав. кафедрой – проф. О.В. Зайратьянц).
Гистологический метод: полученный материал фиксировали в 10% нейтральном забуференном формалине и по общепринятой методике заливали в парафиновые блоки. Изготовленные из них на микротоме Leica (Leica, Германия) гистологические срезы, толщиной 4-5 мкм (не менее 2-х срезов с каждого блока), окрашивали гематоксилином и эозином. Препараты изучали и фотографировали, используя микроскоп Leica DM LB (Leica, Германия) с цифровой фотокамерой Olympus (Olympus, Япония).
Для иммуноморфологического исследования использовали иммунопероксидазный метод с применением 5 первичных специфических моноклональных антител.
Гистологические срезы толщиной 4-5 мкм, изготовленные из парафиновых блоков с помощью микротома Leica (Leica, Германия) помещали на покрытые специальным адгезивом (APES-ацетон) предметные стекла. Эндогенную пероксидазу в депарафинированных срезах блокировали 3% перекисью водорода. Демаскировку антигенов производили по стандартной схеме, в микроволновой печи в течение 20 минут при 600В в 0,1 М растворе цитратного буфера (рH 6,0).
В качестве первичных специфических использовали 5 моноклональных антител производства компаний Dako (Дания) и Lab Vision (в составе Thermo Fisher Scientific, США) к: маркеру пролиферирующих клеток, ядерному белку Ki-67; сосудисто-эндотелиальному фактору роста (СЭФР, клон G153-694); трансформирующему фактору роста – β1 (ТФР-β1); иммуноглобулинам М (IgM); иммуноглобулинам G (IgG).
После инкубации гистологических срезов с первичными антителами (рабочее разведение антисывороток – 1:50-100, время инкубации – 45-60 мин при температуре 37ºС), их обрабатывали вторичными биотилированными антикроличьими иммуноглобулинами.
Для последующей визуализации результата реакции связывания антигена с антителом использовали систему детекции «Ultra Vision LP Value HRP Polymer» производства Lab Vision (в составе Thermo Fisher Scientific, США). Применяли фермент (пероксидазу хрена) в присутствии субстрата (перекиси водорода) и специального реактива (3,3– диаминобензидин).
Конечный продукт реакции представляет собой мелкие коричневатые гранулы в участках локализации антигена. Для таких антигенов, как Ki-67 это – ядра клеток, для других – цитоплазма и/или клеточные мембраны клеток, в определенной мере – экстрацеллюлярный матрикс.
Проводили общепринятые отрицательные и положительные контрольные процедуры на используемые реагенты и ткани при обработке параллельных срезов.
После проведения иммунопероксидазной реакции гистологические препараты докрашивали гематоксилином, изучали и фотографировали, используя световой микроскоп Leica DM-LB (Leica, Германия) с цифровой фотокамерой Olympus (Olympus, Япония).
Результаты иммуногистохимических реакций оценивали с помощью полуколичественного морфометрического метода [5] и вычисляли коэффициенты экспрессии изучаемых антигенов.
Коэффициент экспрессии рассчитывали для каждого наблюдения по формуле: К = сумма (Б х П), деленная на 100, где Б — интенсивность окраски в баллах, а П — процент окрашенных клеток при каждом значении Б.
Результаты исследования и обсуждение
Возраст женщин, которые вошли в исследование, был в пределах от 45 до 55 лет и составил в среднем 48,2±2,9 лет.
Соматически пациентки отобранных групп статистически не имели отличий.
Анализируя гинекологическую заболеваемость, мы отметили, что у всех обследуемых пациенток в анамнезе имелись различные гинекологические заболевания. Наиболее распространенной гинекологической патологией были: доброкачественные процессы шейки матки, воспалительные заболевания нижних отделов половой системы (урогенитальная инфекция, вагинальный кандидоз, бактериальный вагиноз), хронический сальпингоофорит. У 27,5% женщин отмечено сочетание двух и более гинекологических заболеваний.
Характеристика гинекологических заболеваний у обследуемых женщин представлена в таблице 1.
Таблица 1. Перенесенные гинекологические заболевания у обследуемых женщин.
| Гинекологическое заболевание | I группа, n=204 | II группа, n=50 | III группа, n=66 | | абс | % | абс | % | абс | % | | Доброкачественные заболевания шейки матки | 109 | 53,4* | 27 | 54,0* | 38 | 57,5% | | Аденомиоз | 34 | 16,6* | 11 | 22,0* | 14 | 21,2* | | Миома матки небольших размеров | 47 | 23,0* | 14 | 28,0* | 14 | 21,2* | | Гиперпластический процесс эндометрия, полип эндометрия | 14 | 6,8** | 4 | 8,0** | 11 | 16,6** | | Нарушение менструального цикла | 74 | 36,2** | 24 | 48,0** | 42 | 63,6** | | Хронический сальпингоофорит | 47 | 23,0* | 11 | 22,0* | 14 | 21,2* | | Хронический эндометрит (морфологически верифицированный) | 15 | 7,3* | 3 | 6,0* | 8 | 12,1** | | Функциональные кисты яичников | 21 | 10,2* | 8 | 16,0* | 9 | 13,6* | | Урогенитальная инфекция (микоплазменная, хламидийная) | 131 | 64,2* | 31 | 62,0* | 58 | 87,8** | | Вагинальный кандидоз, бактериальный вагиноз | 183 | 89,7* | 45 | 90,0* | 62 | 93,9* | | Бесплодие первичное, вторичное | 6 | 2,9* | 2 | 4,0* | 6 | 9,9** |
Примечание: * – р>0,05 разность показателей не достоверна; ** – р<0,05 разность показателей достоверна.
Обращает на себя внимание, что в III группе достоверно чаще встречались такие гинекологические заболевания как урогенитальная инфекция, хронический эндометрит, гиперпластические процессы эндометрия, бесплодие. Кроме того, более чем в половине наблюдений в III группе (63,6%) в анамнезе имелись указания на нарушения менструального цикла длительностью более 1 года (меноррагия, менометроррагия, ациклические маточные кровотечения).
Изучение анамнеза репродуктивной функции показало, что у подавляющего большинства обследуемыхженщин имело место большое количество беремен-
ностей (табл. 2). Родами завершились беременности у 85% пациенток I группы, у 96% II группы и у 93,9% женщин III группы.
Таблица 2. Исходы предыдущих беременностей у обследуемых пациенток.
| Исходы предыдущих беременностей | I группа, n=204 | II группа, n=50 | III группа, n=66 | | абс | % | абс | % | абс | % | | Искусственный аборт | 144 | 70,5 | 35 | 70,0 | 58 | 87,8 | | Самопроизвольный выкидыш | 74 | 36,2 | 18 | 36,0 | 28 | 46,6 | | Неразвивающаяся беременность | 58 | 28,4 | 12 | 24,0 | 34 | 51,5 | | Роды | 201 | 85 | 48 | 96 | 62 | 93,9 | | Нерожавшие | 3 | 1,5 | 2 | 4,0 | 4 | 6,0 |
Особо следует обратить внимание на большое число искусственных абортов, самопроизвольных выкидышей и неразвивающейся беременности у всех обследуемых женщин. Среднее число искусственных абортов у пациенток III группы составило 2,2 на одну женщину, самопроизвольных выкидышей – 1,7, неразвивающейся беременности – 0,8.
В I и II группах количество выполненных искусственных абортов было также высокое, но все же несколько ниже, чем в III группе (2,0 и 1,9 соответственно). Среднее число самопроизвольных выкидышей – 1,4 и 1,6 соответственно, среднее число неразвивающейся беременности – 0,6 и 0,6, соответственно.
На основании данных морфологического исследования во всех случаях была диагностирована простая или сложная форма гиперплазии эндометрия без
атипии.
Обращает на себя внимание, что у 66 пациенток (25,6%) наряду с гиперплазией эндометрия был диагностирован хронический эндометрит. Характерными морфологическими признаками хронического эндометрита в наших исследованиях были: наличие очагов склероза, очаговый фиброз стромы, лимфомакрофагальная инфильтрация стромы, наличие лимфоидных фолликулов (рис. 1).
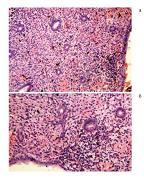 | Рисунок 1: Простая (типическая) гиперплазия эндометрия.
Умеренно выраженные лимфо-макрофагальная инфильтрация, местами с тенденцией к формированию лимфоидных фолликулов и выраженный склероз стромы. Полнокровие сосудов, кровоизлияния. Окраска гематоксилином и эозином, х200. |
Иммуноморфологическое исследование проведено у 55 пациенток: у 20 женщин с простой гиперплазией эндометрия без атипии, у 15 – со сложной гиперплазией эндометрия без атипии, у 20 женщин с сочетанием гиперпластического процесса эндометрия с хроническим эндометритом.
Одним из наиболее достоверных иммуноморфологических маркеров пролиферативной активности клеток является уровень экспрессии ядерного белка Ki-67. Его экспрессия определялась нами в соответствующих группах наблюдений.
Результаты проведенного исследования показали, что уровень экспрессии ядерного белка Ki-67 при простой и сложной гиперплазии эндометрия без атипии резко выражен в ядрах эпителия (1,9 ед.) и слабо – в части стромальных клеток (0,1 ед.). В наблюдениях, где гиперпластический процесс эндометрия сочетается с хроническим эндометритом, экспрессия Ki-67 слабо выражена в ядрах эпителия (0,2 ед.) и умеренно – в стромальных клетках (0,3 ед.) (рис. 2-3).
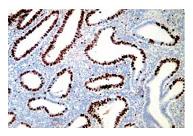 | Рисунок 2: Экспрессия Ki-67 при наличии гиперпластического проценсса эндометрия (ГПЭ).
Экспрессия Кi-67 резко выражена в ядрах эпителия (1,9 ед.) и слабо выражена – в части стромальных клеток (0,1 ед.). Непрямой иммунопероксидазный метод с антителами к Ki-67, х120. |
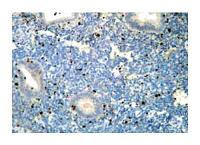 | Рисунок 3: Экспрессия Ki-67 при гиперпластическом процессе эндометрия (ГПЭ) и хронической эндометрите.
Экспрессия Кi-67 слабо выражена в ядрах эпителия (0,2 ед.) и умеренно – в стромальных клетках (0,3 ед.). Непрямой иммунопероксидазный метод с антителами к Ki-67, х120. |
Уровень экспрессии ядерного белка Ki-67 представлен в таблице 3.
Таблица 3. Экспрессия маркера пролиферации Ki-67 в обследуемых группах. р<0,05.
| Ki-67 | Простая гиперплазия эндометрия, n=20 | Сложная гиперплазия эндометрия, n=15 | ГПЭ + хрон. эндометрит, n=20 | | Ядра эпителия | 1,8 ед. | 2,0 ед. | 0,2 ед. | | Стромальные клетки | 0,1 ед. | 0,1 ед. | 0,3 ед. |
Таким образом, при наличии воспалительного процесса в эндометрии отмечается более высокий уровень пролиферативной активности в стромальном компоненте.
Трансформирующие факторы роста – ТФР-α и ТФР-β обладают сильным митогенным и пролиферативным эффектом, участвуют в росте и созревании клеток. ТФР-β1 изучен лучше и оказывает многогранное действие на ангиогенез, пролиферацию клеток (при невысокой концентрации – повышает), процессы склероза (при высокой концентрации).
При наличии гиперпластического процесса эндометрия без атипии экспрессия ТФР-β1 слабо выражена в эпителии желез (0,4 ед.) и минимально (0,1 ед.) – в стромальных клетках (табл. 4).
Таблица 4. Продукция и накопление ТФР-β1 у обследуемых женщин с гиперпластическими процессами эндометрия. р<0,05.
| ТФР-β1 | Простая гиперплазия эндометрия, n=20 | Сложная гиперплазия эндометрия, n=15 | ГПЭ + хрон. эндометрит, n=20 | | Эпителий желез | 0,4 ед. | 0,3 ед. | 0,9 ед. | | Стромальные клетки | 0,1 ед. | 0,3 ед. | 1,7 ед. |
В случаях сочетания гиперплазии эндометрия и хронического эндометрита экспрессия ТФР-β1 повышается: умеренно выражена в эпителии желез (0,9 ед.) и значительно в стромальных клетках – 1,7 ед.
Достоверных различий в продукции и накопления ТФР-β1 при простой и сложной гиперплазии эндометрия нами выявлено не было.
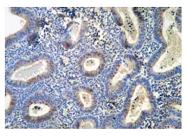 | Рисунок 4: Экспрессия ТФР-β1 при гиперпластическом процессе эндометрия (ГПЭ).
Экспрессия ТФР-β1 слабо выражена в эпителии желез (0,4 ед.) и минимально – в стромальных клетках (0,1 ед.). Непрямой иммунопероксидазный метод с антителами к ТФР-β1, х120. |
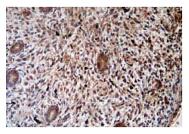 | Рисунок 5: Экспрессия ТФР-β1 при гиперпластическом процессе эндометрия (ГПЭ).
Экспрессия ТФР-β1 слабо выражена в эпителии желез (0,8 ед.) и резко выра жена – в стромальных клетках (1,7 ед.). Непрямой иммуно-пероксидазный метод с антителами к ТФР-β1, х200. |
Таким образом, экспрессия ТФР-β1 повышается именно в наблюдениях, где есть хронический воспалительный процесс в эндометрии, особенно в очагах склероза, что является вполне закономерным.
Активность неоангиогенеза (роста новых сосудов) также оценивали иммуноморфологически, выявляя уровень экспрессии факторов роста сосудов (СЭФР) – гликопротеина, связывающегося только с эндотелиальными клетками и стимулирующего их пролиферацию.
При простой и сложной гиперплазии эндометрия без атипии экспрессия СЭФР выражена в эпителии (2,2 ед.) и слабо выражена в строме – 0,7 ед. Это свидетельствует о невысоком уровне ангиогенеза у этой группы пациенток (табл. 5).
Таблица 5. Экспрессия СЭФР у обследуемых женщин. р<0,05.
| СЭФР | Простая гиперплазия эндометрия | Сложная гиперплазия эндометрия | ГПЭ + хрон. эндометрит | | Эпителий желез | 2,3 ед. | 2,2 ед. | 2,2 ед. | | Стромальные клетки | 0,4 ед. | 0,7 ед. | 1,7 ед. |
При сочетании с хроническим эндометритом продукция и накопление СЭФР в эпителии желез меняется незначительно и в среднем составляет 2,2 ед. В стромальных клетках экспрессия СЭФР значительно повышается (1,7 ед.), что говорит об активно идущих процесса ангиогенеза.
Таким образом, полученные нами данные свидетельствуют о высокой частоте сочетания гиперпластических процессов эндометрия и хронического эндометрита – 25,6%, т.е. каждый четвертый случай.
Результаты иммуногистохимического исследования показали, что экспрессия маркера пролиферации Ki-67 и факторов роста СЭФР и ТФР-β1 различна при простой и сложной гиперплазии эндометрия без атипии и гиперплазии эндометрия в сочетании с хроническим эндометритом.
В наблюдениях с хроническим эндометритом пролиферация эпителия желез эндометрия ниже, чем при гиперплазии без хронического эндометрита. А для клеток стромы, наоборот, выше при хроническом эндометрите. Кроме того, в части случаев с признаками не хронического, а острого эндометрита этой закономерности нет, следовательно, можно сделать вывод о том, что острый очаговый или диффузный (реже) эндометрит может развиваться как осложнение гиперплазии с очагами некроза (реактивное, чаще очаговое воспаление).
Инфильтрация зоны повреждения эндометрия воспалительными клетками (плазмоциты, лимфоциты, макрофаги) приводит к дополнительной продукции и выраженному накоплению ТФР-β (ведущий цитокин репарации) и выраженному накоплению компонентов внеклеточного матрикса. Об этом свидетельствует высокий уровень продукции и накопления ТФР-β1 как в эпителии желез, так и в стромальных клетках.
 | Рисунок 6: Экспрессия СЭФР при гиперпластическом процессе эндометрия (ГПЭ).
Экспрессия СЭФР выражена в эпителии (2,3 ед.), слабо – в строме (0,4 ед.). Непрямой иммунопероксидазный метод с антителами к СЭФР, х120. |
 | Рисунок 7: Экспрессия СЭФР при гиперпластическом процессе эндометрия (ГПЭ) в сочетании с хроническим эндометритом.
Экспрессия СЭФР выражена в эпителии (2,3 ед.) и строме (1,7 ед.). Непрямой иммунопероксидазный метод с антителами к СЭФР, х200. |
Однако, длительно существующий воспалительный процесс или отсутствие противовоспалительного лечения может привести к тому, что индукция накопления компонентов внеклеточного матрикса в зоне повреждения из адаптивной реакции «перерастет» в патологическую, приводя к развитию склероза и фиброза и деградации компонентов внеклеточного матрикса.
Высокий уровень экспрессии ядерного маркера пролиферации Ki-67 и СЭФР, который отмечен при сочетании гиперпластических процессов в слизистой матки и хронического эндометрита, отражает высокую пролиферативную активность эпителия желез и стромы эндометрия и указывает на активно идущие процессы неоангиогенеза, а значит, еще раз указывает на имеющиеся разрушения во внеклеточном матриксе.
Таким образом, именно хронический воспалительный процесс усиливает межклеточные и стромально-паренхиматозные нарушения, уже имеющиеся при гиперпластических процессах эндометрия. Это приводит к активации процессов склерозирования и неоангиогенеза, которые стимулируют пролиферацию клеток и способствуют прогрессированию опухолевого процесса. Воспаление потенцирует пролиферативную активность железистого эпителия и стромы гиперплазированного эндометрия, а значит, создает благоприятные условия для атипической трансформации клеток. Это еще раз подтверждает роль хронического воспаления в злокачественной трансформации эндометрия.
Литература:
1. Кузнецова И.В. Гиперпластические процессы эндометрия.– М., 2009.-.48с
2. Сухих Г.Т., Шуршалина А.В.. Хронический эндометрит, М., 2010, 64 с
3. Ferquhar C.M, Lethaby A, Sowter M et al. An evaluation of risk factors for endometrial
hyperplasia in premenopausal women with abnormal menstrual bleeding II Am. J. Obstet. Gynecol. – 1999. – Vol. 181, N 3. – P. 525-529.
4. Horn L.C., Schnurbusch U, Hentschel B, Einenkel J Risk of progression in complex and atypical endometrial hyperplasia: clinicipathologic analysis in cases with and without progestogen treatment II Int. J. Gynecol. Cancer. – 2004. – Vol. 14, N 2. – P. 348-353.
5. Kinsel L., Szabo E., Greene G., et al. // Cancer Res. – 1989. – V. 49. – Р.1052-1056
6. Montgomery B.E., Damm G.S., Dunton C.J. et al. Endometrial hyperplasia: a review // Obstetrical and Gynecologocal Survey.-2004.– Vol. 59, №5.– Р.368-378
HYPERPLASIC PROCESS OF ENDOMETRIUM: FEATURES OF PROLIFERATIVE ACTIVITY WHEN COMBINED WITH CHRONIC ENDOMETRITIS
Sheshukova N.A., Makarov I.O., Ovsyannikova T.V.
I.M. Sechenov First Moscow State Medical University (MSMU), State Educational Institution of Higher Professional Training of the Ministry of Healthcare and Social Development
City Clinical Hospital № 14 named after V.G. Korolenko Department of Health, Moscow
Abstract: a comprehensive pathomorphological and immunohistochemical study of the scales of endometrium is carried out. With hyperplastic the process of endometrium and chronic endometritis are noted the high proliferating activity of the stroma of glands (Ki-67), the high expression of TFR-β and SEFR, which indicates the actively going processes of neoangiogenezes and disturbance in the extracellular matrix. Inflammation raises to a higher power the proliferating activity of epithelium and stroma of the hyperplasiized endometrium, and it means, creates favorable conditions for the
atypical transformation of cells.
Key words: hyperplastic processes of endometrium, cronic endometritis, marker of proliferative activity, TFR-β. SEFR |
|