ВОПРОСЫ ПАТОГЕНЕЗА СИНДРОМА ТРУССО
Воробьев А.В., Чабров А.М., Савченко А.А., Булгакова С.В., Макацария А.Д. Дата публикации на сайте: 2015-09-21 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
После первых наблюдений А. Труссо в 1865 г. появилось множество исследований, посвященных взаимоотношениям между патогенезом злокачественных новообразований и тромбоза. В настоящее время уже не вызывает сомнений то, что у больных онкологическими заболеваниями тромбозы и тромбоэмболии возникают значительно чаще, и мигрирующий венозный тромбоз является проявлением паранеопластического синдрома у пациентов со злокачественными новообразованиями. В целом любое проявление тромбогеморрагических осложнений у больных со злокачественными новообразованиями называют синдромом Труссо. Кроме непосредственно тромботических осложнений, таких как венозная тромбоэмболия, у больных злокачественными новообразованиями нередко развиваются серьезные геморрагические осложнения, являющиеся следствием системной коагулопатии, в т.ч. ДВС, тромботической гемолитической микроангиопатии и избыточным фибринолизом. В основе патофизиологии синдрома Труссо, кроме классической триады Вирхова, лежит гиперпродукция тканевого фактора (ТФ), основного инициатора внешнего пути свертывания. При этом значительный выброс микрочастиц из опухолевых клеток, несущих тканевой фактор, имеет решающее значение не только для образования тромба, но и прогрессирования роста новообразования. Опухолевые клетки активируют коагуляционный каскад или систему фибринолиза, создавая условия для дальнейшего своего распространения, стимуляции ангиогенеза, повышения сосудистой проницаемости, что, в свою очередь, способствует метастазированию.
DOI: 10.17749/2070-4968.2015.9.2.099-109
Статья поступила: 26.05.2014 г.; в доработанном виде: 18.06.2015 г.; принята к печати: 22.06.2015 г.
Конфликт интересов
Авторы заявляют об отсутствии необходимости раскрытия финансовой поддержки или конфликта интересов в отношении данной публикации.
Все авторы сделали эквивалентный вклад в подготовку публикации.
Для цитирования
Воробьев А.В., Чабров А.М., Савченко А.А., Булгакова С.В., Макацария А.Д. Вопросы патогенеза синдрома Труссо. Акушерство, гинекология и репродукция. 2015; 2: 99-109.
Pathogenesis of Trousseau’s syndrome
Vorobev A.V., Chabrov A.M., Savchenko A.A., Bulgakova S.V., Makatsaria A.D.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Summary
After the first observations A. Trousseau in 1865, it is exist a host of studies on the relationship between the pathogenesis of cancer and thrombosis. There is now no doubt that the cancer patients occur much more frequently thromboembolism, and migratory venous thrombosis is a manifestation of paraneoplastic syndrome in cancer patients. In general, any manifestation of thrombohemorrhagic complications in cancer patients called Trousseau’s syndrome. While thrombotic complications such as venous thromboembolism are most frequent in cancer patients, may also experience severe bleeding symptoms due to systemic coagulopathies, including disseminated intravascular coagulation, haemolytic thrombotic microangiopathy, and hyperfibrinolysis. The basis of the pathophysiology of Trousseau’s syndrome, except the classic triad of Virchow, is overproduction of tissue factor, the main initiator of extrinsic coagulation pathway. Thus a significant release of microparticles from tumor cells bearing tissue factor is critical not only for the formation of a blood clot, but the growth and progression of tumors. Tumor cells activate the coagulation cascade or fibrinolysis system, providing conditions for its further spread, stimulation of angiogenesis, increased vascular permeability, which in turn promotes metastasis.
Key words
Trousseau’s syndrome, malignancies, thrombotic complications, hemostasis system, metastasis of tumor tissue, DIC, thrombophilia, pathogenesis of thrombotic complications, cancer patients, prevention of thrombosis, hemostasis disorders.
Received: 26.05.2014; in the revised form: 18.06.2015; accepted: 28.06.2015.
Conflict of interests
The author declared that they do not have anything to disclosure regarding funding or conflict of interests with respect to this manuscript.
All authors contributed equally to this article.
For citation
Vorobev A.V., Chabrov A.M., Savchenko A.A., Bulgakova S.V., Makatsaria A.D. Pathogenesis of trousseau’s syndrome. Akusherstvo, ginekologiya i reproduktsiya/Obstetrics, gynecology and reproduction. 2015; 2: 99-109 (in Russian).
Corresponding author
Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004.
E-mail address: alvorobev@gmail.com (Vorobev A.V.).
Ключевые слова: Синдром Труссо, злокачественные новообразования, тромботические осложнения, система гемостаза, метастазирование опухолевой ткани, ДВС синдром, тромбофилия, патогенез тромботических осложнений, онкологические больные, профилактика тромбозов, нарушения гемостаза.
ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава России, Москва
Введение
Общепринято мнение, что именно знаменитый французский врач, профессор парижского университета Арман Труссо (Armand Trousseau, 1801-1867) был первым, кто распознал связь между раком и тромботическими осложнениями [25]. Наряду с множеством открытых им симптомов в клинической гемостазиологии, его имя связывают с «феноменом Труссо» – тромбофлебитами (“phlegmasia alba dolens”) в связи со злокачественными новообразованиями. Также считается, что Арман Труссо впервые отметил связь между идеопатическим венозным тромбозом и скрытым раком. В его работе повторяющиеся тромботические эпизоды описаны как первые симптомы скрыто протекающего и не выявленного роста злокачественной опухоли, значительно опережающие клинические проявления новообразования, причем течение тромбофлебита в этих случаях имеет ряд особенностей – процесс склонен к мигрированию, протекает со слабо выраженной воспалительной реакцией, часты эмболии [6,8,18,26].
Кроме того, он заложил основы изучения и патогенеза тромбофилии при злокачественных новообразованиях, в частности он отмечал, что при раке кровь находится в особом состоянии, предрасполагающем к самопроизвольной коагуляции даже в отсутствии признаков воспаления. В настоящее время уже не вызывает сомнений, что у больных онкологическими заболеваниями тромбозы и тромбоэмболии возникают значительно чаще, о чем свидетельствуют современные многоцентровые исследования. По иронии судьбы, обнаружив у себя тромбофлебит левой ноги в 1867 г., он предопределил прогноз своего заболевания.
Паранеопластический синдром – клинико-лабораторное проявление злокачественной опухоли, обусловленное не ее локальным или метастатическим ростом, а неспецифическими реакциями со стороны различных органов и систем или эктопической продукцией опухолью биологически активных веществ. Иногда паранеопластический синдром является манифестацией злокачественной опухоли [4,8,15]. Клинически венозный тромбоэмболизм и рак имеют два основных проявления: с одной стороны тромбоз может быть единственным клиническим симптомом скрыто протекающего рака, с другой – у пациентов с выявленным раком на всех стадиях заболевания может развиться тромбоз. В клинической онкологии тромботические осложнения относятся к наиболее часто встречающимся паранеопластическим синдромам и проявляются артериальными и венозными тромботическими окклюзиями, мигрирующим тромбофлебитом, эмболией легочной артерии, небактериальным тромбоэндокардитом, парадоксальными кровотечениями, тромботической микроангиопатией [2,14].
В 1977 г. Сакс и его коллеги описали 182 пациента со злокачественными новообразованиями в связи с хроническим диссеминированным внутрисосудистым свертыванием (ДВС) [22]. В исследовании, по крайней мере, один эпизод поверхностного тромбофлебита был у 113 пациентов (62%), были выявлены дополнительные клинические особенности, такие как кровотечения (41%), артериальная эмболия (25%) и тромбоэндокардит (23%). Основываясь на этих наблюдениях, термин «синдром Труссо» был уточнен как более сложный паранеопластический синдром, характеризующийся системной активацией коагуляции, образованием богатых тромбоцитами микротромбов и бородавчатого тромботического эндокардита (иначе известного как эндокардит Либмана-Сакса).
Возросший в последние 20 лет интерес клинических онкологов к взаимосвязи между тромбозом и раком имеет два направления:
1) взаимосвязь тромбоза с лечением рака не только хирургическим способом, но и с помощью химиотерапии игормонотерапии; а также при применении антиангиогенных препаратов, специфической особенностью которых является сосудистая токсичность и стимуляция тем самым тромбообразования;
2) наблюдение за случаями идиопатического или неспровоцированного ВТЭ как предвестниками клинического проявления скрытого онкологического процесса.
Взаимосвязь между тромбозом и раком подтверждается рядом клинических признаков:
– идиопатический (первичный) ВТЭ зачастую служит ранним прогностическим фактором скрытого рака;
– при раке увеличен риск симптоматического и рецидивирующего ВТЭ.
В настоящий момент практически все клинически значимые нарушения свертывания у больных раком называют синдромом Труссо, в т.ч. тромбоэмболические проявления у лежачих больных с терминальной стадией опухоли [18,28]. Поскольку у таких больных патогенез синдрома Труссо явно отличается от классически описанного у пациентов со скрытой или ранней стадией рака или у пациентов с гематологическими злокачественными новообразованиями, важно не только признать эволюцию термина с течением времени, но и определить особенности синдрома при различных формах злокачественного процесса.
Патогенез синдрома Труссо в свете триады Вирхова
В то время как наиболее распространенным клиническим проявлением синдрома является венозная тромбоэмболия (ВТЭ), тромбоз глубоких вен (ТГВ) и легочная эмболия (PE), у ряда пациентов обнаруживаются тромбозы атипичных локализаций, в частности вен верхних конечностей, внутричерепных и висцеральных сосудов. Кроме того, для таких пациентов характерны системные коагулопатии, такие как: декомпенсированный ДВС, гиперфибринолиз, гемолитическая тромботическая микроангиопатия или неспецифический протеолиз.
Развитие артериальных тромбозов наблюдается существенно реже, чем ВТЭ, но особенностью является то, что такие осложнения могут происходить без явных признаковатеросклероза и при полном отсутствии типичных сердечно-сосудистых факторов риска. Характерной особенностью синдрома Труссо является сочетание тромботических и геморрагических осложнений, что представляет серьезные сложности для гематологов и онкологов.
В основе патогенеза паранеоплазии лежит активация как коагуляционного, так и сосудисто-тромбоцитарного звеньев свертывания крови, что обеспечивается:
1) нарушением структурной целостности и функциональной стабильности сосудистого эндотелия опухолевыми клетками и цитокинами;
2) активацией тромбоцитов опухолевыми клетками, приводящей к их повышенной адгезии и агрегации;
3) синтезом прокоагулянтов и ингибиторов фибринолиза опухолевыми клетками;
4) прокоагулянтной активностью опухоль-ассоциированных макрофагов и активированных моноцитов периферической крови [5,9].
Патогенез синдрома Труссо включает в себя все аспекты триады Вирхова: сосудистый стаз, повреждение сосудистой стенки, увеличение свертывающего потенциала крови (см. рис. 1). Венозный застой является типичным компонентом патогенеза, особенно у длительно иммобилизованных больных или больных с инфекционными осложнениями в процессе их лечения, а также при проведении хирургического лечения. Кровоток может быть нарушен частично или полностью из-за компрессии опухолевыми массами или непосредственной инвазии опухоли в стенку сосуда, а также явиться результатом постановки венозного катетера [20,21].
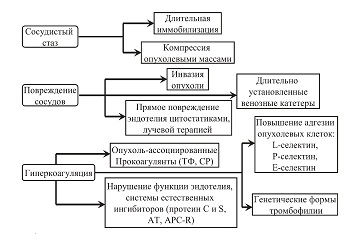 | Рисунок 1: Модификация триады Вирхова. |
Повреждение стенки сосуда может быть обусловлено и циркулирующими воспалительными цитокинами, которые экспрессирует опухолевая ткань, такими как TNF-а или IL-1b и прямого действия цитотоксических лекарственных средств, в результате эндотелиального повреждения. Например, при применении цисплатина было показано, что происходит индукция апоптоза эндотелиальных клеток in vitro, в т.ч. за счет фрагментации мембраны, при этом микрочастицы обладают выраженной прокоагулянтной активностью, что способствует увеличению риска как венозных, так и артериальных тромбозов in vivo.
Кроме того, для злокачественных опухолей характерна инвазия в васкуляризированные ткани пораженного органа раковыми клетками и образование новых кровеносных сосудов, то есть опухолевый неоангиогенез. Прокоагулянтные свойства раковых клеток реализуются посредством утечки факторов свертывания из плазмы в интерстициальное пространство микросреды опухоли, секрецией цитокинов, хемокинов и специфических опухолевых муцинов, а также прямой инвазией раковых клеток в кровеносные или лимфатические сосуды.
Раковая клетка может инициировать коагуляцию непосредственно через взаимодействие с тромбоцитами и/или системами коагуляции и фибринолиза, чтобы генерировать тромбин, или косвенно, стимулируя мононуклеарные клетки, что ведет к синтезу различных прокоагулянтов. Запуск свертывания может рассматриваться как особый тип воспалительной реакции на стимулы типа повреждения стенки сосуда или внутрисосудистой агрегации раковых клеток, или поступление клеток опухоли в кровоток. Увеличение прокоагулянтной активности, присутствие всех компонентов системы коагуляции локально в области расположения опухоли и уменьшенная деятельность противосвертывающей системы ведет к гиперкоагуляции, как результату злокачественного развития.
Состояние гиперкоагуляции при раке обусловлено комплексом взаимодействий опухолевых клеток и их продуктов с клетками организма. Опухолевые клетки могут напрямую активировать коагуляционный каскад, что ведет к тромбозам, или проявлять прокоагулянтные свойства, или ингибировать антикоагулянтную систему эндотелия, тромбоцитов, моноцитов, макрофагов [7,11,23].
Активация свертывания крови при раке – сложный феномен, включающий множество компонентов системы коагуляции и многочисленные взаимодействия между опухолевыми клетками и клетками крови, включая тромбоциты, моноциты, эндотелиальные клетки.
В процессе опухолевой прогрессии маскировка злокачественно трансформированных клеток от эффекторов иммунной системы в числе прочего обеспечивается наличием барьера из фибрина. Фибриновые волокна всегда присутствуют в любой опухолевой ткани, что особенно характерно для зоны активной пролиферации малигнизированных клеток. В зоне опухоли мощный фибриновый барьер образуется за счет извращения процессов перманентной стимуляции фибриногенеза и сопутствующего фибринолиза. Со стороны опухолевых клеток инициирующее воздействие на компоненты системы гемостаза и процесс образования фибрина опосредуется присутствующими в зоне опухоли макрофагами, реакция которых на малигнизированные клетки выражается усилением продукции провоспалительных цитокинов TNFα, IL-1, IL-6, IL-8 и других активных молекул. На поверхности клеток эндотелия и активированных макрофагов провоспалительные цитокины индуцируют экспрессию тканевого фактора свертывания крови [10,24].
В очаге опухолевого роста защитная роль фибрина искажается, и трансформированные клетки используют фибриновую сетку как механический барьер от клеток иммунной системы. Фибрин также повышает устойчивость малигнизированных клеток к химиотерапии.
Фибрин необходим для обеспечения возможностей роста малигнизированных клеток. Нити фибрина формируют тракт перемещения злокачественно трансформированных клеток в структуре ткани и одновременно выступают в качестве защитного барьера от цитотоксических клеток иммунной системы (см. табл. 1).
Таблица 1. Роль системы гемостаза в росте и прогрессирование злокачественного новообразования.
Фибрин является для раковых клеток и основным трофическим материалом. Раковые клетки потребляют фибрин в 10 раз более активно, чем другие белки. В структуре опухолевой ткани фибрин выполняет, кроме того, функцию внеклеточного матрикса. Нити фибрина оказывают стимулирующее действие на фибробласты, присутствие которых в опухоли необходимо для поддержания концентрации потребляемых раковыми клетками ростовых факторов и секреции компонентов, входящих в строму опухолевой ткани. Злокачественно трансформированные клетки используют фибрин в своих целях благодаря их способности определенным образом контролировать активность фибринолитической компоненты гемостаза – системы плазмин – тканевые ингибиторы – активаторы плазминогена [12,17].
В норме система гемостаза всегда находится в динамическом равновесии: при этом всегда ингибирующие влияния преобладают над активирующими, и лишь при повреждении высвобождаются из клеток крови и поврежденного эндотелия, а также экспонируются подэндотелиальные активирующие факторы. Однако следует отметить, что при наличии исходного активирующего агента ответ развивается крайне быстро и с гораздо большей интенсивностью, то резервы активирующей системы намного превосходят резервы репаративной. Это ведет к локальной гиперкоагуляции и гиперагрегации, что способствует образованию клеточного микротромба, а затем образования внутри и вокруг него фибринового матрикса. Все эти изменения направлены на как можно скорейшее ограничение очага поражения, а затем создание условий для скорейшего восстановления нормального состояния. При развитии патологического процесса равновесие смещается либо в сторону гипокоагуляции и преобладания фибринолиза, либо в сторону гиперкоагуляции и образования фибриновой сети. В этих условиях ДВС-синдром развивается при наличии системного повреждающего фактора, когда повреждение не только не локализовано, но и продолжительно по времени. Злокачественные новообразования, безусловно, являются одним из таких системных факторов – то есть агенты, высвобождаемые из раковых клеток, действуют не только в месте первичного очага злокачественного роста, но и в местах гематогенного проникновения раковых клеток через эндотелиальный барьер в составе микротромбоэмболов [13,19].
Патогенез тромботических осложнений
Опухолевые клетки обладают разнообразием прокоагулянтных свойств, включая экспрессию клетками тканевого фактора (TF), секрецию цистеинового ракового прокоагулянта (СР), секрецию косвенных прокоагулянтных цитокинов, таких, как интерлейкины-1 и -8, фактор некроза опухоли (TNF) и сосудистый фактор роста эндотелия (VEGF). Они также активизируют тромбоциты и через экспрессию интегрина формируют адгезию тромбоцитов с эндотелием кровеносных сосудов. Под влиянием опухолевых клеток уменьшается секреция эндотелиальной клеткой тканевого активатора плазминогена (tPA) и экспрессии тромбомодулина (ТМ), увеличивается синтез ингибитора активатора плазминогена (PAI-1). Наблюдается повышенное количество активированных моноцитов/макрофагов в кровотоке рядом с опухолью. Эти клетки экспрессируют TF на своей поверхности как часть иммунного ответа организма на опухоль и/или как ответ на секрецию продуктов опухоли (см. рис. 2).
 | Рисунок 2: Взаимодействие опухолевых клеток с системой гемостаза (Falanga, Rickles). |
Опухолевые клетки экспрессируют: а) раковые прокоагулянты, активирующие каскад свертывания: ТФ – тканевой фактор, CP – цистеиновая протеаза; б) активаторы и ингибиторы фибринолиза, а также их рецепторы: u-PA – урокиназный активатор плазминогена, t-PA – тканевой активатор плазминогена, PAI – ингибитор активатора плазминогена, u-PAR – рецепторы урокиназного активатора плазминогена; в) цитокины, взаимодействующие с эндотелием и путем его повреждения активируют прокоагулянтные свойства эндотелиоцитов: ИЛ-1 – интерлейкин-1, ФНО-a – фактор некроза опухоли, VEGF – сосудистый эндотелиальный фактор роста. Кроме того, опухолевые клетки напрямую взаимодейтсвуют с клетками крови: тромбоцитами, эндотелием, моноцитами.
Генерация тромбина и формирование фибрина постоянно обнаруживается у онкологических пациентов, эти процессы приводят к увеличению риска тромбоэмболических осложнений. Особенно важно, что в процессе роста опухоли и метастазирования ключевая роль принадлежит синтезируемому на поверхности раковых клеток фибрину. Формирование фибрина вызвано тканевым фактором (TF), который активирует коагуляционный каскад, активируя фактор X, преобразование протромбина в тромбин и затем фибриногена в фибрин и стабилизацию фибрина [1,2,17].
Для некоторых типов опухолей выявлен повышенный тромботический потенциал, в частности для рака легких, поджелудочной железы, рака желудка, рака яичников, первичные злокачественные опухоли головного мозга (глиомы или глиобластомы, GBM). В связи с этим важно отметить, что тканевой фактор (ТФ), основной инициатор внешнего пути свертывания, сверхэкспрессируется при данных типах опухолей. Степень экспрессии ТФ, по-видимому, коррелирует со степенью дифференцировки опухоли и продукцией ангиогенных факторов роста, таких как VEGF. Аденокарциномы, особенно желудка или поджелудочной железы, также выделяют специфические муцины, являющиеся сайтами связывания для селектинов, которые экспрессируются на активированных тромбоцитах и эндотелиальных клетках (Р-селектин) или лейкоцитах (L-селектин). Поддерживая адгезию между опухолевыми клетками, тромбоцитами, эндотелиальными клетками и лейкоцитами, раковые муцины не только участвуют в прогрессии опухолей, но также и в патогенезе синдрома Труссо. Большая часть муцинов утилизируется печенью, но часть из них остается в кровотоке и взаимодействует с P- и L-селектинами, запуская процесс микротромбообразования сразу по нескольким направлениям. Дополнительные молекулярные механизмы, с помощью которых раковые клетки могут способствовать развитию тромбоза, включают сверхэкспрессию циклооксигеназы-2 (СОХ-2) и ингибитора активатора плазминогена-1 (PAI-1) [7,19,23].
ТФ не только экспрессируется клетками опухоли, но и поступает в кровь из субклеточных мембранных везикул, так называемых плазменных микрочастиц. Микрочастицы освобождаются из нетрансформированных клеток после активации или индукции апоптоза, что является характерной чертой большинства раковых клеток. Микрочастицы обычно обогащены прокоагулянтными отрицательно заряженными фосфолипидами (т.е. фосфатидилсерином) и могут нести ТФ на поверхности. Микрочастицы попадают в кровеносное русло через сосуды микроокружения опухоли. В нескольких исследованиях было показано, что уровень ТФ-несущих микрочастиц в плазме действительно повышен у пациентов с ВТЭ или ДВС, однако в настоящее время окончательно не ясно, непосредственно они участвуют в патогенезе тромботических осложнений или они в целом присутствуют при системной гиперкоагуляции и воспалении.
Что касается роли микрочастиц, несущих ТФ, в патогенезе ВТЭ, получены несколько противоречивые результаты, масштабное исследование, оценивающее связь между ТФ-положительными микрочастицами и ВТЭ у онкологических больных провели Ф.Г. Гиддингс и Н. Макмэн [12].
Кроме ТФ в патогенезе тромботических осложнений также принимает участие цистеиновая протеаза (CP, ЦП), выступающая в роли ракового прокоагулянта, напрямую активируя фактор Х. Также имеет значение и активация внутреннего пути свертывания. В естественных условиях контактная активация фактора XII, имеющая отношение к патогенезу тромбоза, может быть достигнута с помощью отрицательно заряженных полимеров, таких как полифосфаты или нуклеиновых кислот (т.е. РНК, ДНК), активированных тромбоцитов или лейкоцитов, а также некротизированных клеток. Различные факторы роста, выделяемые активированными тромбоцитами вследствие разрушения а-гранул, регулируют процессы клеточной пролиферации.
Особенности диагностики тромботических проявлений синдрома Труссо
Часто ТГВ развивается в илиофеморальном сегменте, тогда как тромбозы глубоких вен голени реже, чем в половине случаев. Подобная закономерность связана с увеличением венозного давления в венах таза, снижением тонуса венозных стенок вследствие изменения гормонального фона, развитием стаза, зачастую компрессией опухолевыми массами. Тромбоз в илиофеморальном сегменте связан с большим риском развития ТЭЛА, чем ТГВ. Тромбоз вен илиофеморального сегмента проявляется болями внизу живота, перитонеальными симптомами, небольшим подъемом температуры и лейкоцитозом. Такая клиническая картина нередко является предметом диагностических ошибок. Наиболее часто дифференциальной диагноз приходится проводить с острым аппендицитом, почечной коликой. Очень важна в данном случае настороженность врача в отношении возможности развития тромбоза [2,3].
В общей популяции в 90% случаях ТГВ развивается в мышцах голеней. Такие тромбозы часто протекают без выраженных клинических симптомов и остаются недиагностированными. Среди симптомных тромбозов 80% составляют проксимальные ТГВ. Дистальные ТГВ редко сами по себе являются причиной ТЭЛА, однако в 25% нелеченный тромбоз голеней прогрессирует и поражает проксимальные вены ног. У пациентов с ТЭЛА при венографии ТГВ обнаруживается в 75% случаев, при этом в 2/3 случаев – это тромбоз проксимальных вен нижних конечностей. Реже проксимальные тромбозы выявляются у пациентов с ТЭЛА мелких ветвей. Клинически же симптомы ТГВ выявляются у пациентов с симптомной ТЭЛА в 25% случаев, а при ультразвуковом исследовании – у 30% пациентов. У 40% пациентов при наличии симптомного проксимального ТГВ данные сцинтиграфии легких свидетельствуют о высокой вероятности наличия ТЭЛА.
При наличии злокачественного новообразования повышается риск развития тромбозов атипичной локализации: вен головного мозга, тромбоз яичниковых вен, тромбоз печеночных вен (синдром Бадда-Киари), подключичных и яремных вен.
Тромбозы обладают склонностью к затяжному течению, вероятно, из-за постоянного присутствия факторов риска тромбоза. Характерно рецидивирующее течение тромбозов, в этом случае следует предположить наличие генетических форм тромбофилиии и АФС. В послеоперационном периоде следует опасаться тромбозов в связи с высокой частотой возникновения эмболии.
На основании литературных данных затруднительно сделать вывод, какие именно виды опухолей обладают наибольшим тромботическим потенциалом. Эта неопределенность, вероятно, вызвана несколькими факторами [4,8,21]:
1. В эпидемиологических исследованиях по заболеваемости ВТЭ при раке, практически невозможно отделить патофизиологические факторы, непосредственно связанные с действием опухоли от тех, которые связаны с сопутствующими заболеваниями или явились результатом лечения основного заболевания.
2. Несмотря на то, что степень распространения опухоли является важным фактором, определяющим тромботический риск, во многих эпидемиологических исследованиях не делается различия между пациентами с локализованными, местно-распространенными или метастатическими формами. Например, пациенты с локализованным раком предстательной железы, имеют довольно низкий риск ВТЭ, особенно без хирургического этапа лечения, в то время как метастатический рак, гормон- рефрактерная форма заболевания, по существу, обладает существенно более высоким риском тромбоза и, вероятнее всего, коагулопатии в рамках ДВС [1,14,27].
3. Результаты эпидемиологических исследований могут отличаться в связи с включением/ исключением венозных и артериальных тромботических осложнений, обнаруженных клинических симптомов, методов визуализации тромбоэмболии или описания результатов аутопсии.
4. Усовершенствование методов лечения злокачественных новообразований в некоторых случаях приводило к ятрогенным побочным тромботическим осложнениям, например, при применении бевацизумаба (моноклональное антитело к VEGF) или иммуномодуляторов (IMiDs), таких как талидомид или леналидомид, что было обнаружено относительно недавно.
5. Также разнообразие гистологических и цитологических форм новообразований, имеющих еще и различия на генетическом и молекулярном уровне, обусловливает различные особенности патогенеза тромботических осложнений. Например, рак легких подразделяется на мелкоклеточный и немелкоклеточный (НМРЛ), последний, в свою очередь, подразделяется на гистологические подтипы: аденокарциному, плоскоклеточный рак и большеклеточную карциному. На основании генетических и молекулярных анализов были выявлены дополнительные подтипы НМРЛ, обусловленные наличием конкретных молекулярных мишеней, в т.ч. мутаций в гене рецептора эпидермального фактора роста (EGFR) и транслокации с участием гена киназы анапластической лимфомы (ALK). Эти уточненные данные могут быть важны для понимания патогенеза синдрома, особенно в свете показанных в эксперименте различных путях активации или инактивации мутаций в онкогенах (например K-RAS, EGFR, PML/RAR-альфа, MET) и гены-супрессоры опухолей (например, p53, PTEN), что непосредственно влияет на прокоагулянтную активность раковых клеток.
Многие заболевания могут усугублять течение опухолевого процесса и дополнительно стимулировать систему гемостаза, что, в свою очередь, может приводить к тромбоэмболическим состояниям или коагулопатии потребления. К основным заболеваниям, в значительной степени ухудшающим прогноз течения злокачественного процесса и повышающим риск развития тромбогеморрагических осложнений относят следующие:
– сердечно-сосудистые заболевания: ишемическая болезнь сердца, гипертоническая болезнь, атеросклероз;
– патология сосудов: системные заболевания, поражающие преимущественно сосудистое русло, сахарный диабет;
– системные заболевания соединительной ткани;
– болезни печени и почек;
– эндокринные заболевания.
Наиболее тромбогенным коморбидным состоянием является АФС и генетические формы тромбофилии.
Как было описано выше, звеньев в цепочке развития патогенеза при опухолевом росте выявлено значительное количество, более того, по мере роста опухоли каскад развития тромбофилии приобретает лавинообразное течение, то есть каскад развивается по принципу обратной положительной связи, что, в конечном итоге неизбежно приводит к развитию ДВС-синдрома и истощению факторов свертывания.
Наибольшее диагностическое значение имеют ТАТ, F1+2, РАР, FDP, D-димер, PF4, растворимые селектины (см. табл. 2).
Таблица 2. Маркеры активации системы гемостаза.
Важной проблемой в онкологии являются тромбозы редких локализаций, такие как тромбоз печеночных вен (синдром Бадда-Киари), селезеночных, мезентериальных, яичниковых вен, вен сетчатки, головного мозга, воротной вены, подмышечной и подключичной вен. Такие тромбозы являются очень серьезной патологией, которая часто остается нераспознанной и диагностируются только на аутопсии. Симптомы этих угрожающих состояний большинстве своем неспецифичны.
Ключевую роль в патогенезе тромбозов редкой локализации играют наследственные тромбофилии в сочетании с основным заболеванием. Тромбозы редких локализаций развиваются у 25% пациентов с дефицитом AT III. При наличии наследственных тромбофилий риск тромбоза мезентериальных вен повышается в 100 раз. Так, в общей популяции тромбоз данной локализации является крайне редкой патологией (0,01%, по данным аутопсий у пациентов хирургического стационара), тогда как у пациентов с дефицитом АТ III мезентериальный тромбоз развивается в 10% случаев, при дефиците протеина С – в 6%, а при дефиците протеина S – в 4% случаев. Наследственные и приобретенные тромбофилии играют важную роль и патогенезе тромбоза вен сетчатки. АФС выявляется до 50% случаев у пациентов с тромбозом данной локализации. При наличии мутации FV Leiden риск тромбоза сетчатки повышается в 6 раз, а при наличии мутации протромбина G20210A – в 8 раз [16]. Открытие и детальное изучение тромбофилитических состояний, а также все более широкое применение КТ и МРТ позволяет на сегодняшний день проводить своевременную диагностику тромботических осложнений редкой локализации.
В настоящее время не вызывает сомнения патофизиологическая и клиническая взаимосвязь между онкологическим процессом и развитием нарушений гемостаза. Последние имеют чрезвычайно сложный характер, у больных злокачественными новообразованиями имеется риск развития как геморрагических, так и тромботических осложнений. Но все же наиболее актуальной проблемой современной онкологии является профилактика тромбозов у больных раком. Кроме того, в ходе экспериментальных исследований доказано, что влияние на систему гемостаза может привести к изменениям степени и скорости роста опухоли и метастазов. Клиническим отображением данного факта является то, что применение антикоагулянтов (преимущественно НМГ) у больных злокачественными новообразованиями ранних стадий позволит существенно улучшить результаты их лечения.
Как заявил Аджит Варки в своем обзоре, есть несколько определений и несколько механизмов синдрома Труссо, поскольку не существует какого-либо одного универсального пути, по которому развивается множество паранеопластических аномалий свертывания. Тем не менее, огромный прогресс был достигнут в разграничении некоторых клеточных и молекулярных механизмов, лежащих в основе злокачественного роста, связанного с микро- и макрососудистым тромбозом, многие из которых уже имеют варианты потогенетического лечения.
В связи с этим стандартизация методов диагностики, глубокое понимание патогенеза тромботических осложнений, взаимосвязь процессов активации свертывающей системы и опухолевого роста и метастазирования является ключом к профилактике или, по крайней мере, ранней диагностике синдрома Труссо и скрытого онкологического процесса.
Литература:
1. Воробьев А.В. Состояние тромбоцитарного звена гемостаза у онкогинекологических больных. Материалы VI российского форума «Мать и дитя». 2004: 318-319.
2. Макацария А.Д., Воробьев А.В., Бицадзе В.О. Злокачественные новообразования, тромбофилия, тромбозы. Монография. М. 2008; 650 с.
3. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Ассоциация флебологов России, Всероссийское общество хирургов. М. 2010.
4. Цыб А.Ф., Сушкевич Г.Н., Балуда М.В., Воробьев А.В., Чабров А.М. Принципы профилактики тромботических осложнений у онкологических больных (солидные образования). Пособие для врачей. Обнинск. 2008; 42 с.
5. Bharthuar A., Khorana A.A., Hutson A. et al. Circulating microparticle tissue factor, thromboembolism and survival in pancreaticobiliary cancers. Thromb Res. 2013; 132: 180-184.
6. Chaturvedi S., Sidana S., Elson R., Khorana A.A., McCrae K.R. Symptomatic and incidental venousthromboembolic disease are both associated withmortality in patients with prostate cancer. PLoSOne 2014; 9: e94048.
7. Claussen C., Rausch A.V., Spath B. et al. Clinical significance of hemostatic activation markers inwomen with suspected ovarian cancer. Oncol Res Treat. 2014; 37: 669.
8. Dammacco F., Vacca A., Procaccio P. et al. Cancer-related coagulopathy (Trousseaus syndrome): review of the literature and experience of a singlecenter of internal medicine. ClinExp Med 2013; 13: 85-97.
9. Davila M., Robles-Carrillo L., Unruh D. et al. Microparticle association and heterogeneity oftumor-derived tissue factor in plasma: is it important for coagulation activation? ThrombHaemost. 2014; 12: 186-196.
10. Demers M., Wagner D.D. NETosis: a new factor intumor progression and cancer-associated thrombosis. SeminThrombHemost. 2014; 40: 277-283.
11. Fuchs T.A., Brill A., Wagner D.D. Neutrophil extracellular trap (NET) impact on deep vein thrombosis. ArteriosclerThromb Vase Biol. 2012; 32: 1777-1783.
12. Geddings J.E., Mackman N. Tumor-derived tissuefactor-positive microparticles and venous thrombosisincancer patients. Blood. 2013; 122: 1873-1880.
13. Hernandez C., Orbe J., Roncal C. et al. Tissue factorexpressed by microparticles is associated withmortality but not with thrombosis in cancer patients. ThrombHaemost. 2013; 110: 598-608.
14. Hyman D.M., Soff G.A., Kampel L.J. Disseminatedintravascular coagulation with excessive fibrinolysis in prostate cancer: a case series and review ofthe literature. Oncology. 2011; 81: 119-125.
15. Khorana AA. Risk assessment for cancer-associated thrombosis: what is the best approach? Thromb Res. 2012; 129: 10-15.
16. Kitchens C.S. The contact system. Arch Pathol Lab Med. 2002 Nov; 126 (11): 1382-6.
17. Kocatiirk B., Versteeg H.H. Tissue factor isoformsin cancer and coagulation: may the best isoformwin. Thromb Res 2012; 129: 69-75.
18. Langer F., Bokemeyer C. Crosstalk between cancerand haemostasis. Implications for cancer biologyand cancer-associated thrombosis with focus ontissue factor. Hamostaseologie. 2012; 32: 95-104.
19. Lo L., Valentine H., Harrison J. et al. Tissue factorexpression in the metaplasia-adenoma-carcinomasequence of gastric cancer in a European population. Br I Cancer. 2012; 107: 1125-1130.
20. Mackman N. New insights into the mechanisms ofvenous thrombosis. J Clin Invest. 2012; 122: 2331-2336.
21. Rak J., Yu J.L., Luyendyk J., Mackman N. Oncogenes, trousseau syndrome, and cancer-related changesin the coagulome of mice and humans. Cancer Res. 2006: 66: 10643-10646.
22. Sack G.H. Jr, Levin J., Bell W.R. Trousseaus syndrome and other manifestations of chronic disseminated coagulopathy in patients with neoplasms: clinical, pathophysiologic, and therapeuticfeatures. Medicine (Baltimore) 1977; 56: 1-37.
23. Thaler J., Preusser M., Ay C. et al. Intratumoral tissue factor expression and risk of venous thromboembolism in brain tumor patients. Thromb Res. 2013; 131: 162-165.
24. Thaler I., Ay C., Mackman N. et al. Microparticle-associated tissue factor activity in patients with pancreatic cancer: correlation with clinicopathologicalfeatures. Eur I Clin Invest. 2013; 43: 277-285.
25. Trousseau A. Phlegmasiaalbadolens. Clinique Medicale de lHotel-Dieu de Paris. 1865; 3: 654-712.
26. Varki A. Trousseaus syndrome: multiple definitions and multiple mechanisms. Blood. 2007; 110; 1723-1729.
27. Vorobiev A.V., Makatsaria A.D., Chabrov A.M. Thrombophilia markers in cancer patients during chemotherapy and radiation therapy. Pathophysiology of haemostasis and thrombosis. 2006; 35 (1-2): A20.
28. Van Doormaal F.K. Terpstra W., Van Der Griend Ret al. Is extensive screening for cancer in idiopathicvenous thromboembolism warranted? J ThrombHaemost. 2011; 9: 79-84.
References:
1. Vorobev A.V. Status platelet hemostasis in patients with gynecological cancer. Proceedings of the VI Russian forum «Mother and Child» [Sostoyanie trombotsitarnogo zvena gemostaza u onkoginekologicheskikh bol’nykh. Materialy VI rossiiskogo foruma «Mat’ i ditya». (in Russian)]. 2004: 318-319.
2. Makatsariya A.D., Vorob’ev A.V., Bitsadze V.O. Malignancies, thrombophilia, thrombosis. Monograph [Zlokachestvennye novoobrazovaniya, trombofiliya, trombozy. Monografiya. (in Russian)]. Moscow. 2008; 650 s.
3. Russian clinical recommendations for diagnosis, treatment and prevention of venous thromboembolic complications. Phlebology Association of Russia, Russian Society of Surgeons [Rossiiskie klinicheskie rekomendatsii po diagnostike, lecheniyu i profilaktike venoznykh tromboembolicheskikh oslozhnenii. Assotsiatsiya flebologov Rossii, Vserossiiskoe obshchestvo khirurgov. (in Russian)]. Moscow. 2010.
4. Tsyb A.F., Sushkevich G.N., Baluda M.V., Vorobev A.V., Chabrov A.M. The principles of prevention of thrombotic events in patients with cancer (solid education). Manual for physicians [Printsipy profilaktiki tromboticheskikh oslozhnenii u onkologicheskikh bol’nykh (solidnye obrazovaniya). Posobie dlya vrachei. (in Russian)]. Obninsk. 2008; 42 s.
5. Bharthuar A., Khorana A.A., Hutson A. et al. Circulating microparticle tissue factor, thromboembolism and survival in pancreaticobiliary cancers. Thromb Res. 2013; 132: 180-184.
6. Chaturvedi S., Sidana S., Elson R., Khorana A.A., McCrae K.R. Symptomatic and incidental venousthromboembolic disease are both associated withmortality in patients with prostate cancer. PLoSOne 2014; 9: e94048.
7. Claussen C., Rausch A.V., Spath B. et al. Clinical significance of hemostatic activation markers inwomen with suspected ovarian cancer. Oncol Res Treat. 2014; 37: 669.
8. Dammacco F., Vacca A., Procaccio P. et al. Cancer-related coagulopathy (Trousseau’s syndrome): review of the literature and experience of a singlecenter of internal medicine. ClinExp Med. 2013; 13: 85-97.
9. Davila M., Robles-Carrillo L., Unruh D. et al. Microparticle association and heterogeneity oftumor-derived tissue factor in plasma: is it important for coagulation activation? ThrombHaemost. 2014; 12: 186-196.
10. Demers M., Wagner D.D. NETosis: a new factor intumor progression and cancer-associated thrombosis. Semin Thromb Hemost. 2014; 40: 277-283.
11. Fuchs T.A., Brill A., Wagner D.D. Neutrophil extracellular trap (NET) impact on deep vein thrombosis. ArteriosclerThromb Vase Biol. 2012; 32: 1777-1783.
12. Geddings J.E., Mackman N. Tumor-derived tissuefactor-positive microparticles and venous thrombosisincancer patients. Blood. 2013; 122: 1873-1880.
13. Hernandez C., Orbe J., Roncal C. et al. Tissue factorexpressed by microparticles is associated withmortality but not with thrombosis in cancer patients. Thromb Haemost. 2013; 110: 598-608.
14. Hyman D.M., Soff G.A., Kampel L.J. Disseminatedintravascular coagulation with excessive fibrinolysis in prostate cancer: a case series and review ofthe literature. Oncology. 2011; 81: 119-125.
15. Khorana A.A. Risk assessment for cancer-associated thrombosis: what is the best approach? Thromb Res. 2012; 129: 10-15.
16. Kitchens C.S. The contact system. Arch Pathol Lab Med. 2002 Nov; 126 (11): 1382-6.
17. Kocatiirk B., Versteeg H.H. Tissue factor isoformsin cancer and coagulation: may the best isoformwin. Thromb Res. 2012; 129: 69-75.
18. Langer F., Bokemeyer C. Crosstalk between cancerand haemostasis. Implications for cancer biologyand cancer-associated thrombosis with focus ontissue factor. Hamostaseologie. 2012; 32: 95-104.
19. Lo L., Valentine H., Harrison J. et al. Tissue factorexpression in the metaplasia-adenoma-carcinomasequence of gastric cancer in a European population. Br I Cancer. 2012; 107: 1125-1130.
20. Mackman N. New insights into the mechanisms ofvenous thrombosis. J Clin Invest. 2012; 122: 2331-2336.
21. Rak J., Yu J.L., Luyendyk J., Mackman N. Oncogenes, trousseau syndrome,
and cancer-related changesin the coagulome of mice and humans. Cancer Res. 2006: 66: 10643-10646.
22. Sack G.H. Jr, Levin J., Bell W.R. Trousseau’s syndrome and other manifestations of chronic disseminated coagulopathy in patients with neoplasms: clinical, pathophysiologic, and therapeuticfeatures. Medicine (Baltimore). 1977; 56: 1-37.
23. Thaler J., Preusser M., Ay C. et al. Intratumoral tissue factor expression and risk of venous thromboembolism in brain tumor patients. Thromb Res. 2013; 131: 162-165.
24. Thaler I., Ay C., Mackman N. et al. Microparticle-associated tissue factor activity in patients with pancreatic cancer: correlation with clinicopathologicalfeatures. Eur I Clin Invest. 2013; 43: 277-285.
25. Trousseau A. Phlegmasiaalbadolens. Clinique Medicale de l’Hotel-Dieu de Paris. 1865; 3: 654-712.
26. Varki A. Trousseaus syndrome: multiple definitions and multiple mechanisms. Blood. 2007; 110; 1723-1729.
27. Vorobiev A.V., Makatsaria A.D., Chabrov A.M. Thrombophilia markers in cancer patients during chemotherapy and radiation therapy. Pathophysiology of haemostasis and thrombosis. 2006; 35 (1-2): A20.
28. Van Doormaal F.K. Terpstra W., Van Der Griend Ret al. Is extensive screening for cancer in idiopathicvenous thromboembolism warranted? J ThrombHaemost. 2011; 9:
79-84.
Сведения об авторах:
Воробьев Александр Викторович – к.м.н., доцент кафедры акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Земляной Вал, 62, стр. 1, Москва, Россия, 109004. Тел.: +7 (495) 788-58-40. Е-mail: alvorobev@gmail.com.
Чабров Андрей Михайлович – к.м.н., заведующий гинекологическим отделением Онкологического клинического диспансера No1 Департамента здравоохранения города Москвы. Адрес: ул. Волочаевская, д. 36, Москва, Россия, 109033. Тел.: +7 (495) 361-62-55.
Савченко Александр Анатольевич – к.м.н., врач гинекологического отделения Онкологического клинического диспансера No1 Департамента здравоохранения города Москвы. Адрес: ул. Волочаевская, д. 36, Москва, Россия, 109033. Тел.: +7 (495) 361-62-55.
Булгакова Светлана Владимировна – к.м.н., врач гинекологического отделения Онкологического клинического диспансера No1 Департамента здравоохранения города Москвы. Адрес: ул. Волочаевская, д. 36, Москва, Россия, 109033. Тел.: +7 (495) 361-62-55.
Макацария Александр Давидович – д.м.н., член-корреспондент РАН, профессор, заведующий кафедрой акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Земляной Вал, 62, стр. 1, Москва, Россия, 109004. Тел.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
About the authors:
Vorobev Alexander Viktorovitch – MD, Ph.D., Associate Professor, Department of Obstetrics and Gynecology, Faculty of Medical and Preventive Medicine First Moscow Medical Sechenov University. address: ul. Zemlyanoy Val, 62, p. 1, Moscow, Russia, 109004. Tel.: +7 (495) 788-58-40. e-mail: alvorobev@gmail.com.
Chabrov Andrey Mikhailovitch – MD, Ph.D., head of gynecological department Clinical Oncological Dispensary No1 Moscow Health Department. Address: ul. Volochaevskaya, 36, Moscow, Russia, 109033. Tel.: +7 (495) 361-62-55.
Savchenko Aleksandr Anatolevich – MD, Ph.D., gynecological department Clinical Oncological Dispensary No1 Moscow Health Department. Address: ul. Volochaevskaya, 36, Moscow, Russia, 109033. Tel.: +7 (495) 361-62-55.
Bulgakova Svetlana Vladimirovna – MD, Ph.D., gynecological department Clinical Oncological Dispensary No1 Moscow Health Department. Address: ul. Volochaevskaya, 36, Moscow, Russia, 109033. Tel.: +7 (495) 361-62-55.
Makatsariya Aleksandr Davidovich – MD, corresponding member of the Russian Academy of Sciences, Professor, Head of the Department of Obstetrics and Gynecology, Faculty of Medical and Preventive, First Moscow State Medical Sechenov University. Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004. Tel.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru
|