ЭПИДЕМИОЛОГИЯ, ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ПОЗДНИХ ПРЕЖДЕВРЕМЕННЫХ РОДОВ
Козлов П.В.1, Иванников Н.Ю.2, Кузнецов П.А.1, Богаева И.И.1 Дата публикации на сайте: 2015-06-04 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Преждевременные роды продолжают оставаться важнейшей медицинской и социальной проблемой во всем мире и в значительной мере определяют перинатальную заболеваемость и смертность. В структуре преждевременных родов более половины приходится на поздние преждевременные роды (ППР). Перинатальная смертность при поздних преждевременных родах минимальна, но все же более 25% всех детей, родившихся в сроках 34(0)-36(6) нед., получают лечение в отделении реанимации и интенсивной терапии. В обзорной статье приведен анализ современного взгляда на проблему ППР, а также на профилактику заболеваемости новорожденных.
Epidemiology, etiology and pathogenesis of late preterm labour
Kozlov P.V.1, Ivannikov N.Yu.2, Kuznetsov P.A.1, Bogaeva I.I.1
1The Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of the Russian Federation, Moscow
2Maternity hospital №1, Moscow
Abstract: preterm labour (PL) is one of the most important worldwide medical and social problems. PL is the main reason of perinatal mortality and morbidity. More than 50% of all PL are late PL (labour at 34(0) – 36(6) weeks). Perinatal mortality during late PL is minimal, but more than 25% of these children still are admitted to the intensive care unit. Modern view on the late PL problem and perinatal morbidity prophylaxis are provided in the article.
Key words: late preterm labour, RDS, prophylaxis.
Ключевые слова: поздние преждевременные роды, РДС плода, профилактика.
1 ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва
2 ГБУЗ ГКБ № 67 имени Л.А. Ворохобова ДЗМ (Филиал Родильный дом № 1), Москва
DOI: 10.17749/2313-7347.2015.9.1.068-076
Статья поступила: 04.07.2014 г.; в доработанном виде: 15.01.2015 г.; принята к печати: 29.01.2015 г.
Конфликт интересов
Авторы заявляют об отсутствии необходимости раскрытия финансовой поддержки или конфликта интересов в отношении данной публикации.
Все авторы сделали эквивалентный вклад в подготовку публикации.
Для цитирования
Козлов П.В., Иванников Н.Ю., Кузнецов П.А., Богаева И.И. Эпидемиология, этиология и патогенез поздних преждевременных родов. Акушерство, гинекология и репродукция. 2015; 1: 68-76.
Преждевременные роды продолжают оставаться важной медико-социальной и демографической проблемой и являются основной причиной перинатальной заболеваемости и смертности. Согласно данным ВОЗ ежегодно в мире происходит около 15 млн преждевременных родов, из них 11,9 млн недоношенных рождается в Африке, Азии, Латинской Америке и Карибском архипелаге, а самый низкий показатель частоты преждевременных родов в Европе – 6,2% [14,17,24].
Несмотря на развитие современных перинатальных технологий, частота преждевременных родов имеет тенденцию к росту, что, в первую очередь, обусловлено увеличением элективных прерываний беременности и количества многоплодных беременностей вследствие распространения вспомогательных репродуктивных технологий [3,40,48]. Кроме того, внедрение современного диагностического оборудования и разработка ранних прогностических критериев неблагоприятных исходов у плода обеспечивает возможность раннего выявления плодов высокого перинатального риска (задержка роста плода, пороки и аномалии развития, внутриутробная асфиксия), что нередко является причиной досрочного родоразрешения [13,15].
Спонтанные преждевременные роды считают одним из «больших акушерских синдромов». Под этим термином подразумевают акушерские осложнения с общими клиническими проявлениями, в основе которых лежит множество патологических процессов, включающих инфекцию, сосудистую патологию, аномалии развития плода, перерастяжение матки и др. [19].
Преждевременные роды делят на три большие группы: спонтанные (идиопатические), инициированные разрывом плодных оболочек и ятрогенные (индуцированные) преждевременные роды по медицинским показаниям, наиболее частыми из которых являются гипоксия плода, синдром задержки роста плода, преэклампсия, отслойка и предлежание плаценты.
В связи с особенностями акушерской тактики и выхаживания детей в Российской Федерации выделяют следующие гестационные интервалы ПР [4]: 22 (0) – 27 (6) нед., 28 (0) – 30 (6) нед., 31 (0) – 33 (6) и 34 (0) – 36 (6) нед. Преждевременные роды при сроке гестации 34 (0) – 36 (6) нед. (масса плода 2000 г и более) называются поздними. В структуре преждевременных родов доля поздних преждевременных родов (ППР) преобладает и составляет около 52,5-70% [17,31,33]. По данным нашего анализа 8732 случаев преждевременных родов, поздние преждевременные роды составили 53,1%.
Этиология и факторы риска поздних преждевременных родов
В основе спонтанных преждевременные родов могут лежать различные патологические процессы, а их причиной может быть комплексное взаимодействие наследственных факторов и окружающей среды. Данные эпидемиологических исследований свидетельствуют о многообразии этиологических факторов ППР, однако процент инфицированных женщин гораздо меньше, чем в предшествующих группах.
Одним из факторов риска ППР является ожирение. По сравнению с женщинами с нормальным весом полные женщины имеют на 70% более высокий риск преждевременных родов до 37 нед. [34]. К факторам риска ППР также относят и первородящих женщин [27].
Последние исследования ВОЗ доказали, что курение повышает риск преждевременных родов (до 37-й нед. беременности) на 30%. Недоношенные дети рождаются в 6,5-33,5% случаев, в то время как у некурящих – всего в 0,8-11,2% случаев [54].
Выявлена взаимосвязь ППР с преждевременными родами в анамнезе, аномалиями развития матки, многоплодием, сахарным диабетом, патологической прибавкой веса и преэклампсией, тромбофилическими состояниями, отслойкой и предлежанием плаценты, преждевременным разрывом плодных оболочек и, в первую очередь, с реализованным хориоамнионитом [35,57]. В последние годы увеличивается количество индуцированных ППР при развитии ряда акушерских осложнений, в т.ч. преэклампсии, гипоксии плода и СЗРП. Так, по данным C.A. Carreno и соавт. (2011), в структуре показаний индуцированных поздних преждевременных родов на долю СЗРП приходится приблизительно 33% [9].
Перинатальные и постнатальные исходы поздних преждевременных родов
Перинатальная смертность и тяжелые инвалидизирующие осложнения новорожденных при поздних преждевременных родах минимальны [39] и сопоставимы с аналогичными показателями доношенных. Однако по сравнению с доношенными риск неблагоприятного перинатального исхода у новорожденных при ППР все же повышен [55].
Сравнительный анализ перинатальных исходов 6381 ППР и 88867 срочных родов, проведенный M. Khashu и соавт. (2009), показал более высокую мертворождаемость, перинатальную и неонатальную смертность в группе ППР [27]. Доказано, что заболеваемость, частота госпитализаций в отделения интенсивной терапии и продолжительность лечения достоверно выше при ППР по сравнению со своевременными родами [30,32,37]. В структуре заболеваемости при ППР основное место занимают инфекционный осложнения, в т.ч. генерализованная инфекция, тахипноэ новорожденных, гипербилирубинемия, гипогликемия, гипоксическое поражение головного мозга и СДР [8,25,33,37,42].
Факторами риска неблагоприятных перинатальных исходов, реализации СДР и инфекции при ППР являются хориоамнионит, ПРПО, гипертензивные осложнения и кровотечения в период беременности, а также синдром задержки роста плода [20,24].
С точки зрения перинатальной медицины, важным показателем, определяющим постнатальный исход в данной гестационной группе, является заболеваемость новорожденных и отдаленные последствия патологии перинатального периода в отношении когнитивного и психо-физического развития детей.
Дальнейшее развитие недоношенных детей данной гестационной группы имеет высокий риск нарушений неврологических, метаболических и когнитивных функций, в т.ч. более низкий индекс IQ до 6-летнего возраста и плохой успеваемости в школе [32,36,43]. При этом наиболее выраженные соматические, поведенческие и когнитивные нарушения дошкольного возраста наблюдаются у новорожденных с массой до 2500 грамм, а также госпитализированных для лечения в отделения реанимации и интенсивной терапии [7,56]. Более того, доказана связь ППР с высоким риском развития сахарного диабета в подростковом возрасте [11]. В систематических обзорах последних лет показаны связь ППР с развитием бронхиальной астмы в подростковом возрасте и шизофренией [32].
Синдром дыхательных расстройств при поздних преждевременных родах
Термин «синдром дыхательных расстройств» (СДР) объединяет приобретенные заболевания легких неинфекционного генеза, формирующихся в пренатальном и раннем неонатальном периодах и проявляющихся ранним возникновением (в первые 48 ч жизни) и быстрым нарастанием симптомов дыхательной недостаточности на фоне угнетения жизненно важных функций организма. Этот синдром включает ателектазы легких, болезнь гиалиновых мембран и отечно-геморрагический синдром [1].
Степень тяжести и частота реализации СДР прогрессивно снижается с увеличением срока беременности и степени зрелости плода и составляет в сроке 23-25 нед. 91%, в 26-27 нед. – 88%, в 28-29 нед. – 74% и в 30-31 нед. – 52%. В 33-34 нед. частота СДР стремительно уменьшается до 20%, в 35-36 нед.– до 5%, при сроке 37 нед. и более – менее 1% [31].
В связи с тем, что легкие плода практически зрелы, новорожденным данной гестационной группы, как правило, не требуется введения средств для стимуляции созревания сурфактанта. В то же время дыхательные расстройства, в т.ч. СДР и пневмония, определяют высокую частоту госпитализаций в отделения реанимации и интенсивной терапии, проведение длительного и дорогостоящего лечения [18].
Факторы риска СДР многочисленны и разнообразны. К предрасполагающим факторам следует отнести внутриутробные инфекции, перинатальную гипоксию, в т.ч. дистрибутивный и геморрагический шок, вызывающие спазм микроциркуляции и ишемию легочной ткани, переохлаждение, эндокринные дисфункции (транзиторная гипофункция щитовидной железы и надпочечников у новорожденного). С развитием тяжелых форм СДР связано также течение беременности на фоне сахарного диабета [20]. Анализ гендерной структуры постнатальных осложнений, по данным некоторых многоцентровых исследований, показал, что в проведении реанимации и интенсивной терапии преимущественно нуждаются мальчики [31]. Не выявлено достоверной связи между постнатальным исходом и возрастом матери, расой и паритетом [50,55].
Возможной причиной СДР является недостаточность синтеза альвеолярного сурфактанта, его качественный дефект или инактивация на фоне морфологической незрелости легочной ткани, что в большинстве случаев характерно для недоношенности. Одним из возможных факторов риска СДР новорожденного является синдром задержки роста плода (СЗРП). Предполагается, что рост легочной ткани и объем легочной жидкости прямо пропорциональны массе тела плода. В связи с этим при СЗРП может наблюдаться дефицит синтеза сурфактанта. Однако в эксперименте на плодах овец такой зависимости выявлено не было [12].
Отдельного рассмотрения заслуживает вопрос о роли кесарева сечения в риске реализации СДР. Действительно, риск развития респираторных нарушений при ППР связан с методом родоразрешения и значительно возрастает при кесаревом сечении. Так, по данным ряда авторов, доля детей, родоразрешенных путем операции кесарева сечения, среди всех, кому требуется проведение реанимационных мероприятий и интенсивной терапии при ППР, составляет 74,8%. Данный факт указывает на целесообразность включения кесарева сечения в категорию факторов риска по реализации постнатальных осложнений и, в первую очередь, синдрома дыхательных расстройств [18,31]. Частота СДР при кесаревом сечении составляет в 36 нед. 9,2%, в 37 нед. – от 4,3 до 7,0%, в 38 нед. – от 2,2 до 3,0%, а в 39 и более нед. – от 0,1 до 1,0%. Таким образом, риск развития СДР при родоразрешении путем операции кесарева сечения при ППР в 1,5-2,0 раза выше, чем при влагалищных родах [31,53].
Результаты исследования, проведенного в Дании, показали, что с увеличением срока гестации разница в частоте респираторных расстройств между детьми, рожденными через естественные родовые пути и путем операции кесарева сечения, снижается. В сроке 37 нед. относительный риск респираторных расстройств при кесаревом сечении по сравнению с вагинальными родами составил 3,9 (95% ДИ 2,4-6,5), в 38 нед. – 3,0 (95% ДИ 2,1-4,3), а в 39 нед. – лишь 1,9 (95% ДИ 1,2-3,0) [23]. Несмотря на то, что эти исследования проводили в доношенном сроке беременности, результаты их были экстраполированы и на поздние преждевременные роды.
Профилактика синдрома дыхательных расстройств (СДР) плода
Несмотря на то, что исходы для новорожденного ребенка как в отношении смертности, так и в отношении заболеваний при поздних преждевременных родах значительно лучше, чем в группах с меньшим гестационным возрастом, по нашим данным, каждому четвертому ребенку, рожденному в сроке 34-36 (6) нед. требуется лечение в отделении реанимации и интенсивной терапии (ОРИТ) (см. рис. 1). При этом продолжительность лечения в ОРИТ у детей, рожденных в сроках 34-36 (6) нед., статистически значимо не отличалась от детей, рожденных в сроках 31-33 (6) нед. (6,8±0,7 и 7,5±0,6 дней соответственно).
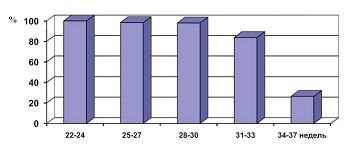 | Рисунок 1: Частота госпитализации недоношенных новорожденных в ОРИТ в зависимости от срока гестации (собственные данные, n=4800 преждевременных родов). |
Также относительно высокой при поздних преждевременных родах остается смертность новорожденных, госпитализированных в ОРИТ, сравнимая с новорожденными в 31-33 нед., а эффективность интенсивной терапии ниже по сравнению с более ранними сроками гестации [27].
Наиболее значимой патологией недоношенных новорожденных, родившихся в сроки 34-36 (6) нед., по нашим данным, является синдром дыхательных расстройств (см. табл. 1).
Таблица 1. Показания к госпитализации в ОРИТ (%) в зависимости от срока гестации (собственные данные, n=2911).
| Основное заболевание | Срок гестации (нед.) |
|---|
| 22-24 | 25-27 | 28-30 | 31-33 | 34-36 |
|---|
| Синдром дыхательных расстройств | 100,0 | 92,3 | 70,8 | 73,7 | 59,3 | | Внутриутробная инфекция | 36,4 | 17,5 | 10,1 | 8,8 | 7,8 | | Внутрижелудочковые кровоизлияния III ст. | 13,6 | 15,8 | 4,3 | 0,7 | 0,5 | | Другие | 9,1 | 6,4 | 14,8 | 16,8 | 32,4 |
Однако в современной литературе нет единой точки зрения на вопрос о тактике ведения поздних преждевременных родов (34-36 нед. беременности), а также профилактики перинатальных осложнений, в т.ч. антенатальной профилактики СДР и внутриутробной инфекции.
Очевидно, что приоритетной задачей должно быть устранение основного фактора риска развития СДР, то есть преждевременных родов. Медикаментозная профилактика, основанная на результатах экспериментальных и клинических исследований, также позволяет в значительной степени снизить частоту респираторных нарушений и неонатальной смертности. Данные литературы указывают на то, что синтез фосфатидилхолина увеличивают тиреоидные гормоны, эстрогены, пролактин, эпидермальный фактор роста, а секрецию фосфолипидов сурфактанта из альвеолоцитов 2-го типа в значительной степени стимулируют глюкокортикоиды. Имеются данные о том, что адренергические агонисты увеличивают секрецию сурфактанта в потенциальные воздушные пространства, и лечение матери b-адренергическими средствами может уменьшить тяжесть СДР новорожденного. Подчеркивается положительная роль ритодрина и других агонистов β2-адренорецепторов в снижении частоты СДР (в 3 и более раза) и неонатальной смертности, не связанных с эффектом пролонгирования беременности [26].
Однако наиболее эффективной и общепризнанной специфической профилактикой СДР, впервые примененной в 1972 г., является глюкокортикоидная терапия (ГКТ).
ГКТ проводится в случаях вероятных преждевременных родов в 24-34 нед. беременности для стимулирования эмбрионального созревания легких, снижения неонатальной и детской смертности, а также увеличения эффективности постнатальной сурфактантной терапии [6,28,29].
Профилактика синдрома проводится парентерально. Оральный путь введения глюкокортикоидов неэффективен и в настоящее время не используется [5].
В качестве наиболее распространенных альтернативных схем применяется введение двух доз бетаметазона по 12 мг, внутримышечно с интервалом в 12-24 ч (общая доза 24 мг) или четырех доз дексаметазона по 6 мг, внутримышечно каждые 8-12 ч (общая доза 24 мг). Положительный эффект наблюдается при экспозиции от 24 до 48 ч и продолжается до 7 сут.
Результаты Кокрейновского обзора 21 исследования (3885 женщин и 4269 новорожденных) свидетельствуют о том, что однократный курс антенатальных кортикостероидов снижает риск младенческой смертности на 31% (95% ДИ 19-42%), частоты РДС – на 44% (95% ДИ 31-57%) и внутижелудочковых кровоизлияний – на 46% (95% ДИ 31-67%). Помимо этого, проведение курса кортикостероидов сопровождалось снижением частоты некротизирующего энтероколита, потребности в респираторной поддержке, а также системных инфекционных процессов [44]. Противопоказаниями к назначению глюкокортикоидов являются острая бактериальная и вирусная инфекция, опоясывающий лишай, обострение язвенной болезни желудка и двенадцатиперстной кишки, недостаточность кровообращения III степени, бактериальный эндокардит, активная форма туберкулеза, тяжелые формы сахарного диабета, остеопороз, тяжелая форма гестоза, порфирия. Остается дискуссионным вопрос о влиянии ГКТ на инфекционные осложнения матери, плода и новорожденного. Имеются данные, указывающие на увеличение частоты инфекционных осложнений с возможным угнетением иммунных реакций у новорожденных, в т.ч. сепсиса, при профилактическом применении глюкокортикоидов [46]. Однако большинство исследований, в т.ч. многоцентровых, подтверждают, что глюкокортикоиды, снижая частоту СДР, не увеличивают риск реализации инфекционных осложнений матери и плода, в т.ч. при ПРПО, не оказывают серьезного влияния на иммунную систему матери и не усиливают иммуносупрессию. Более того, даже при развитии гистологически подтвержденного хориоамнионита профилактическая ГКТ значительно снижает частоту СДР, перивентрикулярной лейкомаляции и неонатальную смертность без увеличения риска сепсиса новорожденного [16,41,55].
Недавно проведенные исследования отдаленных результатов развития детей, получивших один антенатальный курс кортикостероидов, показали отсутствие патологии со стороны сердечно-сосудистой, дыхательной, костной систем, а также нормальное психомоторное и эмоциональное развитие. К побочным эффектам и осложнениям можно отнести гипергликемию, иммуносупрессию и лейкоцитоз [2]. Эти изменения могут имитировать синдром системной воспалительной реакции и служить поводом для досрочного родоразрешения. При сочетанной терапии β-адреномиметиками и глюкокортикоидами в случае их непереносимости или передозировки у беременных может развиться легочно-сердечная недостаточность с отеком легких.
Согласно методическому письму Минздрава РФ и рекомендациям ВОЗ профилактику РДС плода следует проводить в сроках 24-34 нед. беременности [4]. По рекомендациям Королевского общества акушеров-гинекологов Великобритании (RCOG), курс глюкокортикоидов должен проводиться всем пациенткам с угрожающими преждевременными родами в сроке 24 (0)-34 (6) нед. беременности [45]. А по рекомендациям Общества перинатальной медицины Малайзии, сроки проведения необходимо продлить даже до 36 нед. беременности [21]. Таким образом, в большинстве случаев ГКТ необходима для женщин, ожидающих роды до завершения 34 нед. беременности.
После 34 нед., по данным некоторых исследований, проведение антенатальной кортикостероидной терапии без выделения групп риска, не снижает частоту респираторных осложнений [9,22]. По данным последнего многоцентрового исследования, проведение ГКТ при ППР не влияет на общую частоту респираторных нарушений новорожденных, в т.ч. РДС, транзиторное тахипноэ и реанимационные мероприятия в родильном зале с применением ИВЛ [10,22].
В сроках 34-37 нед. ГКТ рекомендуется при беременности высокого риска с плановым родоразрешением путем операции кесарева сечения, при документировано подтвержденной незрелости легких плода (анализ амниатической жидкости с определением индекса лецитин/сфингомиелин, форфатидилглицерола и ламеллярных телец). Было успешно продемонстрировано, что проведение курса профилактики РДС плода кортикостероидами перед кесаревым сечением может снижать частоту перевода в ОРИТ вплоть до 38 (6) нед. беременности. В ходе рандомизированного контролируемого исследования было показано, что относительный риск РДС после курса кортикостероидов перед кесаревым сечением в доношенном сроке по сравнению с плацебо составил 0,46 (95% ДИ 0,23-0,93; P=0,02) [51].
Некоторые из представленных факторов риска уже включены в международные рекомендации. Так, согласно рекомендациям RCOG, профилактику РДC следует проводить всем пациенткам, которым планируется родоразрешение путем операции кесарево сечение в сроке до 38 (6) нед. беременности [45].
Профилактика РДС при задержке роста плода
Существуют данные о том, что антенатальная кортикостероидная терапия влияет на мозговой кровоток плодов с задержкой роста, который отличается от кровотока нормальных плодов [38,49]. Эти данные послужили основой для обоснования необходимости проведения профилактики РДС при СЗРП. В ходе исследования случай-контроль 124 недоношенных новорожденных, появившихся на свет в сроках 26-32 нед., с СЗРП вследствие плацентарной недостаточности, было показано, что частота инвалидности в возрасте двух лет была существенно ниже у детей, получивших перед родами курс кортикостероидной терапии [47]. Несмотря на то, что результаты этого исследования касаются лишь плодов, рожденных до 32 нед. беременности, RCOG рекомендует проводить профилактику РДС плода при СЗРП до 35 нед. беременности.
Таким образом, до настоящего времени не определены показания и группы риска по реализации СДР при ППР.
Учитывая высокую распространенность синдрома дыхательных расстройств новорожденных при ППР и необходимость оказания дорогостоящей медицинской помощи при госпитализации в отделения интенсивной терапии, актуальным, на наш взгляд, является проведение анализа структуры патологии новорожденных при ППР и определения групп риска по реализации постнатальных осложнений. Результаты подобных исследований позволят разработать комплекс профилактических мероприятий по снижению частоты постнатальных осложнений, в т.ч. определению показаний к проведению глюкокортикоидной профилактике СДР при ППР.
Литература:
1. Антонов А.Г., Арестова Н.Н., Байбарина Е.Н. и др. Под ред. Н.Н. Володина Неонатология. Национальное руководство. М. 2009.
2. Козлов П.В. Преждевременный разрыв околоплодных оболочек при недоношенной беременности. (Прогнозирование. Тактика ведения. Перинатальные исходы). Автореф. дисс. …докт. мед. наук. М. 2010.
3. Макаров О.В., Ганковская Л.В., Козлов П.В., Бахарева И.В., Романовская В.В., Кузнецов П.А. Профилактика и ведение невынашивания беременности и преждевременных родов. Акушерство и гинекология. 2008; 5: 19-24.
4. Методическое письмо министерства здравоохранения и социального развития «Преждевременные роды». 2011.
5. ACOG practice bulletin. Clinical management guidelines for obstetrician-gynecologists. Obstet. Gynecol. 2002; 99 (273): 871-873.
6. ACOG Practice Bulletin No. 80: premature rupture of membranes. Clinical management guidelines for obstetrician-gynecologists. Obstet Gynecol. 2007; 109 (4): 1007-1019.
7. Baron I.S., Erickson K., Ahronovich M.D., Baker R., Litman F.R. Cognitive deficit in preschoolers born late-preterm. Early Hum Dev. 2011 Feb; 87 (2): 115-9.
8. Baumert M., Agnieszka L., Krzych L.J., Jacek M., Małgorzata P. Late preterm infants-complications during the early period of adaptation. Ginekol Pol. 2011 Feb; 82 (2): 119-25.
9. Carreno C.A., Costantine M.M., Holland M.G., Ramin S.M., Saade G.R., Blackwell S.C. Medically indicated late preterm births. Am J Obstet Gynecol. 2011 Mar; 204 (3): 263.
10. Carreno C.A., Refuerzo J.S., Holland M.G., Ramin S.M., Saade G.R., Blackwell S.C. The Frequency of Prior Antenatal Corticosteroid Therapy in Late Preterm Birth Pregnancies. Am J Perinatol. 2011 Jun 30.
11. Crump C., Winkleby M.A., Sundquist K., Sundquist J. Risk of diabetes among young adults born preterm in Sweden. Diabetes Care. 2011 May; 34 (5): 1109-13.
12. Cock M.L., Albuquerque C.A., Joyce B.J., Hooper S.B., Harding R. Effects of intrauterine growth restriction on lung liquid dynamics and lung development in fetal sheep. Am J Obstet Gynecol. 2001 Jan; 184 (2): 209-16.
13. Davidoff M.J., Dias T., Damus K. et al. Changes in the gestational age distribution among U.S. singleton births: impact on rates of late preterm birth, 1992-2002. Semin Perinatol. 2006; 30: 8-15.
14. Denney J.M., Culhane J.F., Goldenberg R.L. Prevention of preterm birth. Womens Health (Lond Engl). 2008 Nov; 4 (6): 625-38.
15. Engle W.A., Tomashek K.M., Wallman C. Committee on Fetus and Newborn, American Academy of Pediatrics. «Late-preterm» infants: a population at risk. Pediatrics. 2007 Dec; 120 (6):1390-1401.
16. Elimian A., Verma U., Beneck D., Cipriano R., Visintainer P., Tejani N. Histologic chorioamnionitis, antenatal steroids, and perinatal outcomes. Obstet. Gynecol. Sep. 2000; 96 (3): 333-336.
17. Executive summary for Born too Soon:The Global action report on preterm birth. WHO, PMNCH, March of Dimes, Save the Children, 2012.
18. Gázquez Serrano I.M., Arroyos Plana A., Díaz Morales O., Herráiz Perea C., Holgueras Bragado A. Antenatal corticosteroid therapy and late preterm infant morbidity and mortality. An Pediatr (Barc). 2014 Mar 1. pii: S1695-4033(14)00070-8.
19. Goldenberg R.L., Gravett M.G., Iams J., Papageorghiou A.T., Waller S.A., Kramer M., Culhane J., Barros F., Conde-Agudelo A., Bhutta Z.A., Knight H.E., Villar J. The preterm birth syndrome: issues to consider in creating a classification system. Am J Obstet Gynecol. 2012 Feb; 206 (2): 113-8.
20. Gouyon J.B., Vintejoux A., Sagot P., Burguet A., Quantin C., Ferdynus C.; Burgundy Perinatal Network. Neonatal outcome associated with singleton birth at 34-41 weeks of gestation. Int J Epidemiol. 2010 Jun; 39 (3): 769-76.
21. Guideline on the use of Antenatal Corticosteroids to Prevent Respiratory Distress Syndrome. http://perinatal-malaysia.org/index.cfm?menuid=12&parentid=8
22. Gyamfi-Bannerman C., Gilbert S., Landon M.B., Spong C.Y., Rouse D.J., Varner M.W., Meis P.J., Wapner R.J., Sorokin Y., Carpenter M., Peaceman A.M., OSullivan M.J., Sibai B.M., Thorp J.M., Ramin S.M., Mercer B.M. Eunice Kennedy Shriver National Institute of Child Health; Human Development (NICHD) Maternal-Fetal Medicine Units Network (MFMU). Effect of antenatal corticosteroids on respiratory morbidity in singletons after late-preterm birth. Obstet Gynecol. 2012 Mar; 119 (3): 555-9.
23. Hansen A.K., Wisborg K., Uldbjerg N., Henriksen T.B. Risk of respiratory morbidity in term infants delivered by elective caesarean section: cohort study. BMJ. 2008; 336: 85-7.
24. Hogue C.J., Parker C.B., Willinger M., Temple J.R., Bann C.M., Silver R.M., Dudley D.J., Koch M.A., Coustan D.R., Stoll B.J., Reddy U.M., Varner M.W., Saade G.R., Conway D., Goldenberg R.L. A population-based case-control study of stillbirth: the relationship of significant life events to the racial disparity for African Americans. Am J Epidemiol. 2013 Apr 15; 177 (8): 755-67.
25. Jaiswal A., Murki S., Gaddam P., Reddy A. Early Neonatal Morbidities in Late Preterm Infants. Indian Pediatr. 2010 Nov 30.
26. Kerem E., Dollberg S., Paz I. Prenatal ritodrine administration and the incidence of respiratory distress syndrome in premature infants. J. Perinatol. 1997; 17 (2): 101-106.
27. Khashu M., Narayanan M., Bhargava S., Osiovich H. Perinatal outcomes associated with preterm birth at 33 to 36 weeks gestation: a population-based cohort study. Pediatrics. 2009 Jan; 123 (1): 109-13.
28. Liggins G.C. The prevention of RDS by Maternal Betamethazone Administration. In: Lung maturation and the prevention of hyaline membrane disease. Report of the 70th Ross Conference on Pediatric Research. Columbus, OH: Ross Laboratories. 1976; 97.
29. Liggins G.C., Howie R.N. A controlled trial of antepartum glucocorticoid treatment for prevention of RDS in premature infants. Pediatr. 1972; 50: 515-525.
30. Lubow J.M., How H.Y., Habli M., Maxwell R., Sibai B.M. Indications for delivery and short-term neonatal outcomes in late preterm as compared with term births. Am J Obstet Gynecol. 2009 May; 200 (5): 30-33.
31. Ma X.L., Xu X.F., Chen C., Yan C.Y., Liu Y.M., Liu L., Xiong H., Sun H.Q., Lai J.P., Yi B., Shi J.Y., Du L.Z. National Collaborative Study Group for Neonatal Respiratory Distress in Late Preterm or Term Infants Epidemiology of respiratory distress and the illness severity in late preterm or term infants: a prospective multi-center study. Chin Med J (Engl). 2010 Oct; 123 (20): 2776-80.
32. Machado L.C. Júnior, Passini Júnior R., Rodrigues Machado Rosa I. Late prematurity: a systematic review. J Pediatr (Rio J). 2014 May-June; 90 (3): 221-231.
33. Mally P.V., Bailey S., Hendricks-Muñoz K.D. Clinical issues in the management of late preterm infants. Curr Probl Pediatr Adolesc Health Care. 2010 Oct; 40 (9): 218-33.
34. McDonald S.D., Han Z., Mulla S., Beyene J. Knowledge Synthesis Group. Overweight and obesity in mothers and risk of preterm birth and low birth weight infants: systematic review and meta-analyses. BMJ. 2010 Jul 20; 341: 3428.
35. McDonald S.D., Han Z., Mulla S., Lutsiv O., Lee T., Beyene J. Knowledge Synthesis Group. High gestational weight gain and the risk of preterm birth and low birth weight: a systematic review and meta-analysis. J Obstet Gynaecol Can. 2011 Dec; 33 (12): 1223-33.
36. McGowan J.E., Alderdice F.A., Holmes V.A., Johnston L. Early childhood development of late-preterm infants: a systematic review. Pediatrics. 2011 Jun; 127 (6): 1111-24.
37. Meloni A., Antonelli A., Deiana S., Rocca A., Atzei A., Paoletti A.M., Melis G.B. Late preterm: obstetric management. J Matern Fetal Neonatal Med. 2010 Oct; 23 Suppl 3: 113-5.
38. Miller S.L., Chai M., Loose J., Castillo-Melendez M., Walker D.W., Jenkin G., Wallace E.M. The effects of maternal betamethasone administration on the intrauterine growth-restricted fetus. Endocrinology 2007; 148: 1288-95.
39. Morken N.H., Källen K., Jacobsson B. Outcomes of preterm children according to type of delivery onset: a nationwide population-based study. Paediatr Perinat Epidemiol. 2007; 21 (5): 458-464.
40. Moutquin J.M. Classification and heterogeneity of preterm birth. BJOG. 2003; 110: 30- 33.
41. Pattinson R.C., Makin J.D., Funk M. The use of dexamethasone in women with preterm premature rupture of membranes--a multicentre, double-blind, placebo-controlled, randomised trial. S. Afr. Med. J. Aug. 1999; 89 (8): 865-870.
42. Picone S., Aufieri R., Paolillo P. Infection in late preterm infants. Early Hum Dev. 2014 Mar; 90 (1): 71-4.
43. Picone S., Paolillo P. Neonatal outcomes in a population of late-preterm infants. J Matern Fetal Neonatal Med. 2010 Oct; 23.
44. Roberts D., Dalziel S.R. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database of Systematic Reviews. 2006; Issue 3.
45. Royal College of Obstetricians and Gynaecologists (RCOG). Antenatal corticosteroids to reduce neonatal morbidity and mortality. London (UK): Royal College of Obstetricians and Gynaecologists (RCOG). 2010 Oct.; 13 p.
46. Sauerwald A., Rath W. Lung maturation therapy with glucocorticoids in threatened premature labor. Considerations of risk-benefit in evidence-based medicine. Z. Geburtsh. Neonatol. Nov.-Dec. 2000; 204 (6): 203-209.
47. Schaap A.H., Wolf H., Bruinse H.W. Smolders-De Haas H., Van Ertbruggen I., Treffers P.E. Effects of antenatal corticosteroid administration on mortality and long-term morbidity in early preterm, growth-restricted infants. Obstet Gynecol. 2001; 97: 954-60.
48. Sibai B.M. Preeclampsia as a cause of preterm and late preterm (near-term) births. Semin Perinatol. 2006; 30: 16-19.
49. Simchen M.J., Alkazaleh F. Adamson S.L., Windrim R., Telford J., Beyene J., Kingdom J. The fetal cardiovascular response to antenatal steroids in severe early-onset intrauterine growth restriction. Am J Obstet Gynecol 2004; 190: 296-304.
50. Stone P., Grant S., Sadler L. The use of ultrasound measurement of fetal lung length to predict neonatal respiratory outcome after prolonged premature rupture of the membranes. Fetal. Diagn. Ther. Mar.-Apr. 2005; 20 (2): 152-157.
51. Stutchfield P., Whitaker R., Russell I. Antenatal Steroids for Term Elective Caesarean Section (ASTECS) Research Team. Antenatal betamethasone and incidence of neonatal respiratory distress after elective caesarean section: pragmatic randomised trial. BMJ. 2005; 331: 662.
52. Talge N.M., Holzman C., Wang J., Lucia V., Gardiner J., Breslau N. Late-preterm birth and its association with cognitive and socioemotional outcomes at 6 years of age. Pediatrics. 2010 Dec; 126 (6): 1124-31.
53. Tita A.T., Landon M.B., Spong C.Y., Lai Y., Leveno K.J., Varner M.W., Moawad A.H., Caritis S.N., Meis P.J., Wapner R.J., Sorokin Y., Miodovnik M., Carpenter M., Peaceman A.M., O’Sullivan M.J., Sibai B.M., Langer O., Thorp J.M., Ramin S.M.,
Mercer B.M. Eunice Kennedy Shriver NICHD Maternal-Fetal Medicine Units Network.
Timing of elective repeat cesarean delivery at term and neonatal outcomes.
N Engl J Med. 2009 Jan 8; 360 (2): 111-20.
54. Varner M.W., Silver R.M., Rowland Hogue C.J., Willinger M., Parker C.B., Thorsten V.R., Goldenberg R.L. Association between stillbirth and illicit drug use and smoking during pregnancy. Obstet Gynecol. 2014 Jan; 123 (1): 113-25.
55. Villar J., Abalos E., Carroli G., Giordano D. Heterogeneity of perinatal outcomes in the preterm delivery syndrome. Obstet. Gynecol. Jul. 2004; 104 (1): 78-87.
56. Woythaler M.A., McCormick M.C., Smith V.C. Late preterm infants have worse 24-month neurodevelopmental outcomes than term infants. Pediatrics. 2011 Mar;
127 (3).
57. Zhang X.R., Zeng C.M., Liu J. Risk factors for preterm birth and complications in 287 late preterm infants. Zhongguo Dang Dai Er Ke Za Zhi. 2011 Mar; 13 (3): 177-80.
References:
1. Antonov A.G., Arestova N.N., Baibarina E.N. i dr. Pod red. N.N. Volodina Neonatology. National leadership [Neonatologiya. Natsionalnoe rukovodstvo]. Moscow. 2009.
2. Kozlov P.V. Premature rupture of membranes at preterm pregnancy. (Prediction. Clinical management. Perinatal outcomes). Dr. diss. [Prezhdevremennyi razryv okoloplodnykh obolochek pri nedonoshennoi beremennosti. (Prognozirovanie. Taktika vedeniya. Perinatalnye iskhody). Avtoref. diss. …dokt. med. nauk]. Moscow. 2010.
3. Makarov O.V., Gankovskaya L.V., Kozlov P.V., Bakhareva I.V., Romanovskaya V.V., Kuznetsov P.A. Akusherstvo i ginekologiya. 2008; 5: 19-24.
4. Methodological letter from the Ministry of Health and Social Development, «Premature birth» [Metodicheskoe pismo ministerstva zdravookhraneniya i sotsialnogo razvitiya «Prezhdevremennye rody»]. 2011.
5. ACOG practice bulletin. Clinical management guidelines for obstetrician-gynecologists. Obstet. Gynecol. 2002; 99 (273): 871-873.
6. ACOG Practice Bulletin No. 80: premature rupture of membranes. Clinical management guidelines for obstetrician-gynecologists. Obstet Gynecol. 2007; 109 (4): 1007-1019.
7. Baron I.S., Erickson K., Ahronovich M.D., Baker R., Litman F.R. Cognitive deficit in preschoolers born late-preterm. Early Hum Dev. 2011 Feb; 87 (2): 115-9.
8. Baumert M., Agnieszka L., Krzych L.J., Jacek M., Małgorzata P. Late preterm infants--complications during the early period of adaptation. Ginekol Pol. 2011 Feb; 82 (2): 119-25.
9. Carreno C.A., Costantine M.M., Holland M.G., Ramin S.M., Saade G.R., Blackwell S.C. Medically indicated late preterm births. Am J Obstet Gynecol. 2011 Mar; 204 (3): 263.
10. Carreno C.A., Refuerzo J.S., Holland M.G., Ramin S.M., Saade G.R., Blackwell S.C. The Frequency of Prior Antenatal Corticosteroid Therapy in Late Preterm Birth Pregnancies. Am J Perinatol. 2011 Jun 30.
11. Crump C., Winkleby M.A., Sundquist K., Sundquist J. Risk of diabetes among young adults born preterm in Sweden. Diabetes Care. 2011 May; 34 (5): 1109-13.
12. Cock M.L., Albuquerque C.A., Joyce B.J., Hooper S.B., Harding R. Effects of intrauterine growth restriction on lung liquid dynamics and lung development in fetal sheep. Am J Obstet Gynecol. 2001 Jan; 184 (2): 209-16.
13. Davidoff M.J., Dias T., Damus K. et al. Changes in the gestational age distribution among U.S. singleton births: impact on rates of late preterm birth, 1992-2002. Semin Perinatol. 2006; 30: 8-15.
14. Denney J.M., Culhane J.F., Goldenberg R.L. Prevention of preterm birth. Womens Health (Lond Engl). 2008 Nov; 4 (6): 625-38.
15. Engle W.A., Tomashek K.M., Wallman C. Committee on Fetus and Newborn, American Academy of Pediatrics. «Late-preterm» infants: a population at risk. Pediatrics. 2007 Dec; 120 (6):1390-1401.
16. Elimian A., Verma U., Beneck D., Cipriano R., Visintainer P., Tejani N. Histologic chorioamnionitis, antenatal steroids, and perinatal outcomes. Obstet. Gynecol. Sep. 2000; 96 (3): 333-336.
17. Executive summary for Born too Soon:The Global action report on preterm birth. WHO, PMNCH, March of Dimes, Save the Children, 2012.
18. Gázquez Serrano I.M., Arroyos Plana A., Díaz Morales O., Herráiz Perea C., Holgueras Bragado A. Antenatal corticosteroid therapy and late preterm infant morbidity and mortality. An Pediatr (Barc). 2014 Mar 1. pii: S1695-4033(14)00070-8.
19. Goldenberg R.L., Gravett M.G., Iams J., Papageorghiou A.T., Waller S.A., Kramer M., Culhane J., Barros F., Conde-Agudelo A., Bhutta Z.A., Knight H.E., Villar J. The preterm birth syndrome: issues to consider in creating a classification system. Am J Obstet Gynecol. 2012 Feb; 206 (2): 113-8.
20. Gouyon J.B., Vintejoux A., Sagot P., Burguet A., Quantin C., Ferdynus C.; Burgundy Perinatal Network. Neonatal outcome associated with singleton birth at 34-41 weeks of gestation. Int J Epidemiol. 2010 Jun; 39 (3): 769-76.
21. Guideline on the use of Antenatal Corticosteroids to Prevent Respiratory Distress Syndrome. http://perinatal-malaysia.org/index.cfm?menuid=12&parentid=8
22. Gyamfi-Bannerman C., Gilbert S., Landon M.B., Spong C.Y., Rouse D.J., Varner M.W., Meis P.J., Wapner R.J., Sorokin Y., Carpenter M., Peaceman A.M., O Sullivan M.J., Sibai B.M., Thorp J.M., Ramin S.M., Mercer B.M. Eunice Kennedy Shriver National Institute of Child Health; Human Development (NICHD) Maternal-Fetal Medicine Units Network (MFMU). Effect of antenatal corticosteroids on respiratory morbidity in singletons after late-preterm birth. Obstet Gynecol. 2012 Mar; 119 (3): 555-9.
23. Hansen A.K., Wisborg K., Uldbjerg N., Henriksen T.B. Risk of respiratory morbidity in term infants delivered by elective caesarean section: cohort study. BMJ. 2008; 336: 85-7.
24. Hogue C.J., Parker C.B., Willinger M., Temple J.R., Bann C.M., Silver R.M., Dudley D.J., Koch M.A., Coustan D.R., Stoll B.J., Reddy U.M., Varner M.W., Saade G.R., Conway D., Goldenberg R.L. A population-based case-control study of stillbirth: the relationship of significant life events to the racial disparity for African Americans. Am J Epidemiol. 2013 Apr 15; 177 (8): 755-67.
25. Jaiswal A., Murki S., Gaddam P., Reddy A. Early Neonatal Morbidities in Late Preterm Infants. Indian Pediatr. 2010 Nov 30.
26. Kerem E., Dollberg S., Paz I. Prenatal ritodrine administration and the incidence of respiratory distress syndrome in premature infants. J. Perinatol. 1997; 17 (2): 101-106.
27. Khashu M., Narayanan M., Bhargava S., Osiovich H. Perinatal outcomes associated with preterm birth at 33 to 36 weeks gestation: a population-based cohort study. Pediatrics. 2009 Jan; 123 (1): 109-13.
28. Liggins G.C. The prevention of RDS by Maternal Betamethazone Administration. In: Lung maturation and the prevention of hyaline membrane disease. Report of the 70th Ross Conference on Pediatric Research. Columbus, OH: Ross Laboratories. 1976; 97.
29. Liggins G.C., Howie R.N. A controlled trial of antepartum glucocorticoid treatment for prevention of RDS in premature infants. Pediatr. 1972; 50: 515-525.
30. Lubow J.M., How H.Y., Habli M., Maxwell R., Sibai B.M. Indications for delivery and short-term neonatal outcomes in late preterm as compared with term births. Am J Obstet Gynecol. 2009 May; 200 (5): 30-33.
31. Ma X.L., Xu X.F., Chen C., Yan C.Y., Liu Y.M., Liu L., Xiong H., Sun H.Q., Lai J.P., Yi B., Shi J.Y., Du L.Z. National Collaborative Study Group for Neonatal Respiratory Distress in Late Preterm or Term Infants Epidemiology of respiratory distress and the illness severity in late preterm or term infants: a prospective multi-center study. Chin Med J (Engl). 2010 Oct; 123 (20): 2776-80.
32. Machado L.C. Júnior, Passini Júnior R., Rodrigues Machado Rosa I. Late prematurity: a systematic review. J Pediatr (Rio J). 2014 May-June; 90 (3): 221-231.
33. Mally P.V., Bailey S., Hendricks-Muñoz K.D. Clinical issues in the management of late preterm infants. Curr Probl Pediatr Adolesc Health Care. 2010 Oct; 40 (9): 218-33.
34. McDonald S.D., Han Z., Mulla S., Beyene J. Knowledge Synthesis Group. Overweight and obesity in mothers and risk of preterm birth and low birth weight infants: systematic review and meta-analyses. BMJ. 2010 Jul 20; 341: 3428.
35. McDonald S.D., Han Z., Mulla S., Lutsiv O., Lee T., Beyene J. Knowledge Synthesis Group. High gestational weight gain and the risk of preterm birth and low birth weight: a systematic review and meta-analysis. J Obstet Gynaecol Can. 2011 Dec; 33 (12): 1223-33.
36. McGowan J.E., Alderdice F.A., Holmes V.A., Johnston L. Early childhood development of late-preterm infants: a systematic review. Pediatrics. 2011 Jun; 127 (6): 1111-24.
37. Meloni A., Antonelli A., Deiana S., Rocca A., Atzei A., Paoletti A.M., Melis G.B. Late preterm: obstetric management. J Matern Fetal Neonatal Med. 2010 Oct; 23 Suppl 3: 113-5.
38. Miller S.L., Chai M., Loose J., Castillo-Melendez M., Walker D.W., Jenkin G., Wallace E.M. The effects of maternal betamethasone administration on the intrauterine growth-restricted fetus. Endocrinology. 2007; 148: 1288-95.
39. Morken N.H., Källen K., Jacobsson B. Outcomes of preterm children according to type of delivery onset: a nationwide population-based study. Paediatr Perinat Epidemiol. 2007; 21 (5): 458-464.
40. Moutquin J.M. Classification and heterogeneity of preterm birth. BJOG. 2003; 110: 30- 33.
41. Pattinson R.C., Makin J.D., Funk M. The use of dexamethasone in women with preterm premature rupture of membranes-a multicentre, double-blind, placebo-controlled, randomised trial. S. Afr. Med. J. Aug. 1999; 89 (8): 865-870.
42. Picone S., Aufieri R., Paolillo P. Infection in late preterm infants. Early Hum Dev. 2014 Mar; 90 (1): 71-4.
43. Picone S., Paolillo P. Neonatal outcomes in a population of late-preterm infants. J Matern Fetal Neonatal Med. 2010 Oct; 23.
44. Roberts D., Dalziel S.R. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database of Systematic Reviews. 2006; 3. Art.No.:CD004454.DOI:10.1002/14651858.CD004454. pub2.
45. Royal College of Obstetricians and Gynaecologists (RCOG). Antenatal corticosteroids to reduce neonatal morbidity and mortality. London (UK): Royal College of Obstetricians and Gynaecologists (RCOG). 2010 Oct.; 13 p.
46. Sauerwald A., Rath W. Lung maturation therapy with glucocorticoids in threatened premature labor. Considerations of risk-benefit in evidence-based medicine. Z. Geburtsh. Neonatol. Nov.-Dec. 2000; 204 (6): 203-209.
47. Schaap A.H., Wolf H., Bruinse H.W. Smolders-De Haas H., Van Ertbruggen I., Treffers P.E. Effects of antenatal corticosteroid administration on mortality and long-term morbidity in early preterm, growth-restricted infants. Obstet Gynecol. 2001; 97: 954-60.
48. Sibai B.M. Preeclampsia as a cause of preterm and late preterm (near-term) births. Semin Perinatol. 2006; 30: 16-19.
49. Simchen M.J., Alkazaleh F. Adamson S.L., Windrim R., Telford J., Beyene J., Kingdom J. The fetal cardiovascular response to antenatal steroids in severe early-onset intrauterine growth restriction. Am J Obstet Gynecol 2004; 190: 296-304.
50. Stone P., Grant S., Sadler L. The use of ultrasound measurement of fetal lung length to predict neonatal respiratory outcome after prolonged premature rupture of the membranes. Fetal. Diagn. Ther. Mar.-Apr. 2005; 20 (2): 152-157.
51. Stutchfield P., Whitaker R., Russell I. Antenatal Steroids for Term Elective Caesarean Section (ASTECS) Research Team. Antenatal betamethasone and incidence of neonatal respiratory distress after elective caesarean section: pragmatic randomised trial. BMJ. 2005; 331: 662.
52. Talge N.M., Holzman C., Wang J., Lucia V., Gardiner J., Breslau N. Late-preterm birth and its association with cognitive and socioemotional outcomes at 6 years of age. Pediatrics. 2010 Dec; 126 (6): 1124-31.
53. Tita A.T., Landon M.B., Spong C.Y., Lai Y., Leveno K.J., Varner M.W., Moawad A.H., Caritis S.N., Meis P.J., Wapner R.J., Sorokin Y., Miodovnik M., Carpenter M., Peaceman A.M., OSullivan M.J., Sibai B.M., Langer O., Thorp J.M., Ramin S.M., Mercer B.M. Eunice Kennedy Shriver NICHD Maternal-Fetal Medicine Units Network. Timing of elective repeat cesarean delivery at term and neonatal outcomes. N Engl J Med. 2009 Jan 8; 360 (2): 111-20.
54. Varner M.W., Silver R.M., Rowland Hogue C.J., Willinger M., Parker C.B., Thorsten V.R., Goldenberg R.L. Association between stillbirth and illicit drug use and smoking during pregnancy. Obstet Gynecol. 2014 Jan; 123 (1): 113-25.
55. Villar J., Abalos E., Carroli G., Giordano D. Heterogeneity of perinatal outcomes in the preterm delivery syndrome. Obstet. Gynecol. Jul. 2004; 104 (1): 78-87.
56. Woythaler M.A., McCormick M.C., Smith V.C. Late preterm infants have worse
24-month neurodevelopmental outcomes than term infants. Pediatrics. 2011 Mar; 127 (3).
57. Zhang X.R., Zeng C.M., Liu J. Risk factors for preterm birth and complications in 287 late preterm infants. Zhongguo Dang Dai Er Ke Za Zhi. 2011 Mar; 13 (3): 177-80.
EPIDEMIOLOGY, ETIOLOGY AND PATHOGENESIS OF LATE PRETERM LABOUR
Kozlov P.V.1, Ivannikov N.Yu.2, Kuznetsov P.A.1, Bogaeva I.I.1
1 The Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of the Russian Federation, Moscow
2 Maternity hospital №1, Moscow
Summary
Preterm labour (PL) is one of the most important worldwide medical and social problems. PL is the main reason of perinatal mortality and morbidity. More than 50% of all PL are late PL (labour at 34(0) – 36(6) weeks). Perinatal mortality during late PL is minimal, but more than 25% of these children still are admitted to the intensive care unit. Modern view on the late PL problem and perinatal morbidity prophylaxis are provided in the review article.
Key words
Late preterm labour, RDS, prophylaxis.
Received: 04.07.2014; in the revised form: 15.01.2015; accepted: 29.01.2015.
Conflict of interests
The authors declared that they do not have anything to disclosure regarding funding or conflict of interests with respect to this manuscript.
All authors contributed equally to this article.
For citation
Kozlov P.V., Ivannikov N.Yu., Kuznetsov P.A., Bogaeva I.I. Epidemiology, etiology and pathogenesis of late preterm labour. Akusherstvo, ginekologiya i reproduktsiya/ Obstetrics, gynecology and reproduction. 2015; 1: 68-76 (in Russian).
|
|