МАРКЕРЫ ТРОМБОФИЛИИ У ПАЦИЕНТОК С ОСЛОЖНЕННЫМ ТЕЧЕНИЕМ БЕРЕМЕННОСТИ В АНАМНЕЗЕ И ТРОМБОФИЛИЕЙ
Андреева М.Д. Дата публикации на сайте: 2015-06-04 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Определение уровней молекулярных маркеров тромбофилии (ТАТ, Д-димер) и агрегационной активности тромбоцитов позволяет оценить риск акушерских осложнений у пациенток с осложненным течением беременности в анамнезе и тромбофилией. Мы наблюдали 63 беременные женщины (срок беременности от 6 до 13 нед.) и 86 женщин, планирующих беременность, из которых у 54 была преэклампсия в анамнезе, у 43 – преждевременная отслойка плаценты, у 52 – антенатальная гибель плода. Уровень Д-димера был повышенным у 53,0% с осложненным течением беременности в анамнезе; ТАТ – у 55,0; агрегационная активность тромбоцитов – у 59,7% пациенток. Повышенные уровни молекулярных маркеров тромбофилии являются непосредственным показанием к применению противотромботических препаратов и позволяют контролировать эффективности проводимой терапии.
THROMBOPHILIA MARKERS AT WOMEN PATIENTS WITH HISTORY OF FETO-MATERNAL DISEASE AND THROMBOPHILIA
Andreeva M.D.
Kuban State Medical University, Ministry of Health of Russia, Moscow
Summary
The level of molecular markers of a thrombophilia (TAT, D-dimer) and platelet aggregate formation activity allows to estimate risk of obstetric complications at patients with the complicated pregnancy in the anamnesis and a thrombophilia. We observed 63 pregnant women (pregnancy term from 6 to 13 weeks) and 86 women planning pregnancy from which at 54 there was a preeclampsia in the anamnesis at 43 – a premature detachment of placenta, at 52 – antenatal fetal death. 53.0% patients with the complicated pregnancy in the anamnesis had high D-dimer; TAT – 55.0%; aggregation activity of platelets – 59.7%. High level of molecular markers of a thrombophilia are the indication to application the antithrombotic therapy and allow to control efficiency of this therapy.
Key words Acquired and genetic thrombophilia, pre-eclampsia, antiphospholipid syndrome.
Ключевые слова: приобретенная и генетическая тромбофилия, преэклампсии, антифосфолипидный синдром.
ГБОУ ВПО «Кубанский государственный медицинский университет» Минздрава России, Краснодар
DOI: 10.17749/2313-7347.2015.9.1.063-067
Статья поступила: 10.01.2015 г.; в доработанном виде: 12.02.2015 г.; принята к печати: 09.03.2015 г.
Конфликт интересов
Автор заявляет об отсутствии необходимости раскрытия финансовой поддержки или конфликта интересов в отношении данной публикации.
Для цитирования
Андреева М.Д. Маркеры тромбофилии у пациенток с осложненным течением беременности в анамнезе и тромбофилией. Акушерство, гинекология и репродукция. 2015; 1: 63-67.
Введение
На современном этапе развития акушерства как науки важная роль отводится изучению этиологических связей и патогенетических механизмов развития основных акушерских осложнений, ассоциированных с репродуктивными потерями. Этому способствует бурное развитие медико-биологических наук, гемостазиологии, активное внедрение в медицинскую практику новых биомедицинских технологий.
На сегодняшний день многочисленными работами убедительно доказано, что нарушения в системе гемостаза тромбофилического характера как генетически детерминированные (мутации факторов свертывания, патология противосвертывающей системы и нарушения фибринолиза), так и приобретенные (циркуляция антифосфолипидных антител (АФА), гипергомоцистеинемия) являются самостоятельным этиологическим фактором патологического течения беременности [1,5,7,9].
При тромбофилии нарушаются процессы инвазии трофобласта в децидуальную оболочку, имплантации, плацентации и дальнейшего функционирования плаценты, что сопровождается нарушением кровотока в системе мать – плацента – плод, определяющим то или иное проявление осложнения беременности: невынашивания, преэклампсии (ПЭ), преждевременной отслойки плаценты (ПОНРП), синдрома задержки внутриутробного роста плода (СЗВРП) и др. [1,3,6].
Выявление генетических форм тромбофилии (мутаций FV Leiden, протромбина G20210А, полиморфизмов генов, контролирующих систему фибринолиза (PAI-1, 4G/5G, тканевого активатора плазминогена t-РА I/D, фибриногена-455 A/G, фактора XII и др.), тромбоцитарных рецепторов)), циркуляции АФА и гипергомоцистеинемии на сегодняшний день проводится уже во многих клинических центрах. Определяемые генетические маркеры тромбофилии, несомненно, указывают на риск тромботических осложнений и осложненного течения планируемой или развивающейся беременности, но не отражают степень этого риска, поскольку не позволяют судить о состоянии системы гемостаза в конкретный момент времени.
Проблему определения степени риска тромботических и акушерских осложнений помогает решить выявление специфических молекулярных маркеров активации системы гемостаза, отражающих степень повышения гемостатического потенциала крови. Выделяют маркеры активации тромбоцитов (тромбоцитарный фактор 4, β-тромбоглобулин) и маркеры активации коагуляционного каскада (фрагмент 1+2 протромбина, тромбин-антитромбиновый комплекс (ТАТ), фибрин-мономер, фибринопептид А (ФпА), Д-димер). Однако далеко не все из указанных маркеров пригодны для постановки диагноза, в особенности в ургентных ситуациях [2].
Так, определение маркеров активации тромбоцитов требует использования специфических ингибиторов и обработки крови при 4oС. Исследование фибринопептида А сопряжено со специфической обработкой исследуемой плазмы для удаления всего перекрестно реагирующего фибриногена. Кроме того, ФпА имеет очень короткий период полужизни (3-5 мин.), что требует проведения исследований тотчас после забора крови.
Более длительный период полужизни фрагмента F1+2 протромбина (90 мин.) делает этот тест более предпочтительным, чем ФпА. Кроме того, F1+2, как и ТАТ менее чувствительны in vitro к артефактам, чем ФпА [4]. Определение F1+2 проводится иммуноферментным методом и требует значительного времени.
Для таких маркеров, как фибрин-мономер, ТАТ, Д-димер могут использоваться непосредственно стандартные образцы цитратной плазмы. Однако на определение практически всех из них, за исключением Д-димера, оказывает влияние техника взятия крови, примесь тромбоцитов, что также является осложняющим фактором для получения адекватных и воспроизводимых результатов.
Определение Д-димеров – продуктов деградации поперечно-сшитого фибрина плазмином в этом отношении является исключением. На результаты их исследования практически не влияют вышеперечисленные условия, что и определило значимость оценки данного маркера в клинической практике для диагностики тромбоза. Кроме того, из всех перечисленных маркеров активации гемостаза Д-димеры имеют наиболее длительный период жизни (около 6 ч), что позволяет проводить их определение с наибольшей степенью точности [2,3].
Для определения Д-димера существуют несколько методов: иммуноферментный (ELISA – энзим-связанный иммуносорбентный анализ), латексный, иммунофильтрационный или турбодиметрический методы. В лабораторной практике чаще применяются количественные методы ELISA и полуколичественные латексные тесты. Они являются мануальными методами и позволяют отличить продукты фибринолиза от продуктов фибриногенолиза. В зависимости от используемого метода отрицательная диагностическая значимость теста на Д-димер колеблется от 78 до 100%. И она тем выше, чем больше чувствительность метода, что характерно для иммуноферментных методов исследования [7].
У здоровых людей концентрация Д-димеров не превышает 500 нг FEU (фибриноген эквивалентных единиц)/мл. Повышенная концентрация Д-димеров в плазме является свидетельством активации системы фибринолиза и генерации плазмина, которой предшествует усиление коагуляционного каскада с избыточным образованием нерастворимого фибрина [2,8].
Высокий уровень Д-димера имеет место у большинства пациентов с тромбозом глубоких вен и легочной эмболией. Нормальные величины Д-димера исключают проявление тромбоза глубоких вен и ТЭЛА, что дополнительно подтверждается отрицательными результатами клинических исследований [5].
Целью нашей работы явилось формулирование четких принципов профилактики повторных репродуктивных потерь в группах риска.
Материалы и методы
В нашем исследовании мы определяли уровни молекулярных маркеров тромбофилии у пациенток с осложненным течением и неблагоприятным исходом беременности в анамнезе. Исследование включало 149 пациенток, планировавших рождение ребенка, из которых у 54 в анамнезе была преэклампсия, у 43 – преждевременная отслойка плаценты, у 52 – антенатальная гибель плода (АГП). Антенатальная гибель плода в анамнезе у 16 женщин произошла в сроки беременности от 22 до 28 нед., у 14 – от 29 до 36 нед. беременности; у 22 – при доношенной беременности (от 37 до 41 нед.). Возраст обследованных был от 21 до 39 лет.
Из 149 пациенток 86 женщин на момент консультации беременными не были. Они были обследованы и находились под нашим наблюдением с фертильного цикла на протяжении всей беременности. Из них 25 пациенток имели в анамнезе ПЭ, 29 – ПОНРП и 32 – АГП.
У остальных 63 пациенток на момент первой консультации и обследования срок беременности составлял от 6 до 13 нед. Они также были полностью обследованы и наблюдались далее нами до завершения беременности. Из них 29 пациенток были с ПЭ в анамнезе, 20 – с ПОНРП и 20 – с АГП.
Контрольную группу составили 50 женщин с неотягощенным акушерско-гинекологическим и тромботическим анамнезом.
Результаты
При первичной оценке состояния системы гемостаза было отмечено, что у более половины пациенток с акушерскими осложнениями в анамнезе в I триместре и даже в отсутствие беременности значения молекулярных маркеров тромбофилии были более высокими в сравнении с таковыми у пациенток контрольной группы.
Уровень молекулярного маркера тромбофилии Д-димера был повышенным у 53,0% с осложненным течением беременности в анамнезе: 51,9% пациенток с преэклампсией и АГП; 55,8% – с ПОНРП; ТАТ – у 55,0%: 55,6%, 59,6% и 48,8% соответственно; PAI-1 – у 51,0%: 53,7%, 51,9% и 46,5%; агрегационная активность тромбоцитов – у 59,7% пациенток: 59,3%, 61,5% и 58,1% соответственно.
Уровень Д-димера в среднем составил 2,1±0,3 мкг/мл (в контрольной группе 0,5±0,5). Более высоким уровень Д-димера был у пациенток с тяжелой формой преэклампсии в анамнезе и у пациенток с отягощенным тромботическим анамнезом.
Средние значения агрегационной активности тромбоцитов составили: с АДФ 51,0±5,4; с ристомицином 50,2±3,1; с адреналином 62,1±2,3. Соответствующие показатели в контрольной группе: 38±2; 40±1,5 и 41±1,3. Показатели общеоценочных тестов были близки по значениям.
Выявление генетической и приобретенной тромбофилии в исследуемой группе показало высокую частоту генетических мутаций, предрасполагающих к тромботическим осложнениям, гипергомоцистеинемии, циркуляции антифосфолипидных антител и их сочетаний.
Генетические дефекты гемостаза имели 72,2% обследованных пациенток с преэклампсией в анамнезе, 96,2% пациенток с АГП и 88,4% с ПОНРП.
У пациенток с преэклампсией и ПОНРП преобладали полиморфизмы генов, способствующие гипофибринолизу – PAI-1 675 4G/4G (62,3% и 69,7%), фибриноген 455G/A (18,5 и 20,9%) и мутация MTHFR C677Т (74,1 и 67,4%). Мутация Лейдена присутствовала у 14,8 и 14,0% соответственно.
У пациенток с АГП наиболее распространенными оказались мутация гена MTHFR C677T (57,7%), полиморфизм гена PAI-1 (76,9%) и полиморфизм гена фибриногена 455 G/A (73,1%). Полиморфизм 807С/Т тромбоцитарного рецептора GpIa имели 59,6%, полиморфизм 1565Т/С гена тромбоцитарного рецептора GpIIIa – 23,1%, полиморфизм гена АПФ (D/D) (I/D) – 23,1% женщин. В контрольной группе частота этих мутаций составила 6, 8, 2, 4, 2 и 4% соответственно.
Гипергомоцистеинемия выявлена у 16,7% пациенток с преэклампсией в анамнезе, 19,2% – с АГП и 20,9% – с ПОНРП; циркуляция АФА – у 25,9, 42,6 и 20,9% соответственно.
Всем пациенткам, которые наблюдались с фертильного цикла, нами проводилась комплексная профилактическая подготовка к беременности, в зависимости от результатов клинико-гемостазиологического обследования и анамнестических данных. Беременным пациенткам, с учетом результатов клинико-гемостазиологического обследования и анамнестических данных, проводилась профилактика гестационных осложнений, имевших место в анамнезе, коррекция имеющихся отклонений показателей и ведение в течение всего гестационного периода вплоть до родоразрешения.
Профилактика носила дифференцированный характер, определялась характером имеющегося дефекта гемостаза. Базисной являлась терапия противотромботическими препаратами. В фертильном цикле, в зависимости от состояния функции тромбоцитов, наличия циркуляции антифосфолипидных антител, назначался аспирин (100 мг), с наступлением беременности – препарат низкомолекулярного гепарина (НМГ). Препарат НМГ вводился один раз в сутки подкожно, в определенное время суток с соблюдением равных промежутков между инъекциями в подкожную клетчатку передней брюшной стенки. Доза определялась индивидуально, в зависимости от веса пациентки и выраженности нарушений в системе коагуляции.
Перед назначением НМГ обязательно производилось УЗИ с целью уточнения маточной локализации плодного яйца и отсутствия участков отслойки хориона (особенно при скудных мажущих кровянистых выделениях из половых путей).
Определение динамики уровней молекулярных маркеров тромбофилии (ТАТ, Д-димера), агрегационной активности тромбоцитов и результатов глобального теста, оценивающего функцию протеина С (ПАРУС-тест) позволило контролировать эффективность и корректировать применяемую дозу НМГ.
На 10-й день применения противотромботических препаратов была отмечена положительная динамика снижения уровней молекулярных маркеров тромбофилии (см. рис. 1) и агрегационной активности тромбоцитов (см. рис. 2). Медленнее снижались изначально более высокие значения маркеров у пациенток, обратившихся после 10 нед. беременности.
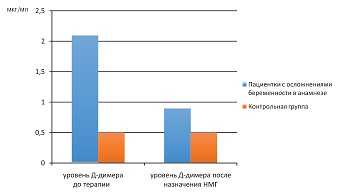 | Рисунок 1: Динамика уровня Д-димера после назначения препарата низкомолекулярного гепарина (НМГ) на 10-й день. |
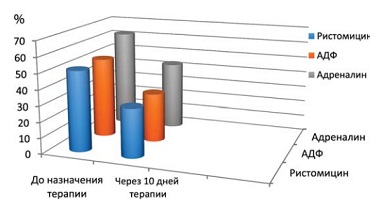 | Рисунок 2: Динамика агрегационной активности тромбоцитов после назначения терапии (на 10-й день). |
Впоследствии именно у этих пациенток (6,7%) отмечались нарушения маточно-плацентарного кровотока. Вероятно, причиной указанных осложнений у этих пациенток было позднее начало профилактических мероприятий.
В 7 (4,7%) случаях нарушение маточно-плацентарного и плодово-плацентарного кровотока сопровождалось внутриутробной задержкой развития плода. При обследовании у этих пациенток было выявлено сочетание генетической мультигенной тромбофилии с циркуляцией АФА (высокие титры антифосфолипидных антител и антител к кофакторам). Несмотря на проводимую комплексную терапию (инфузионная терапия, плазмаферез), на фоне лечения у одной из этих пациенток в 23 нед. беременности произошла антенатальная гибель плода. Возможно, подобное неблагоприятное развитие беременности связано с массивным проникновением в кровоток плода антител к фосфолипидам и кофакторам и, как следствие, сочетание прямого повреждающего эффекта на плод, гемостазиологических нарушений и гипоксических повреждений незрелой ткани плода.
У остальных пациенток беременность протекала благополучно; завершилась рождением живых жизнеспособных детей.
Терапия НМГ продолжалась на протяжении всей беременности под контролем уровней молекулярных маркеров тромбофилии и агрегационной активности тромбоцитов. Во II триместре доза препарата корректировалась.
Контроль уровней молекулярных маркеров тромбофилии в динамике позволял оценивать эффективность проводимой противотромботической профилактики.
В III триместре беременности уровни маркеров тромбофилии (Д-димер, ТАТ) на фоне антикоагулянтной терапии были сопоставимы с таковыми в контрольной группе пациенток.
Родоразрешение во всех случаях было оперативным путем операции кесарева сечения. За сутки до планового родоразрешения НМГ отменялся, с последующим назначением в послеродовом периоде.
В результате 149 беременностей завершились рождением 148 живых жизнеспособных детей. Средний вес новорожденных составил 3350±360, длина – от 49 до 54 см, оценка по шкале Апгар – от 7-8 до 8-9 баллов.
Важным результатом проведенного исследования стало заключение, свидетельствующее о том, что у пациенток, перенесших преэклампсию, АГП или ПОНРП при отсутствии коррекции нарушений в системе гемостаза, сохраняется состояние тромбофилии, а значит и готовность к реализации патологических процессов, патогенетически связанных с активацией системы гемостаза, что обуславливает высокую вероятность рецидива акушерских осложнений
в последующую беременность.
Заключение
Таким образом, диагностика тромбофилии, включающая выявление скрытых генетических дефектов и приобретенных форм, должна предусматривать определение уровней молекулярных маркеров (ТАТ, Д-димер), отражающих реальное состояние системы гемостаза и вероятность реализации скрытой тромбофилии. Тесты на маркеры тромбофилии особенно полезны при отсутствии возможности лабораторной диагностики генетических и приобретенных форм тромбофилии.
Повышенные уровни молекулярных маркеров тромбофилии являются непосредственным показанием к применению противотромботических препаратов и позволяют контролировать эффективность проводимой терапии.
Литература:
1. Тромбогеморрагические осложнения в акушерско-гинекологической практике: Руководство для врачей. Под ред. А.Д. Макацарии. М. 2011; 1056 с.
2. Самбурова Н.В. Клиническое значение контроля маркеров активации свертывания крови при проведении противотромботической терапии у беременных, рожениц и родильниц с тромбофилией: дис....канд. мед. наук. М. 2008; 132 с.
3. Kovac M., Mitic G. et al. Thrombophilia in women with pregnancy-associated complications: fetal loss and pregnancy-related venous thromboembolism. Gynecol. Obstet. Invest. 2010; 69 (4): 233-8.
4. Kupferminc M.J. Thrombophilia and pregnancy. Reprod. Biol. Endocrinol. 2003;
1: 111.
5. Lykke J.A., Bare L.A., Olsen J. et al. Thrombophilias and adverse pregnancy outcomes: results from the Danish National Birth Cohort. J. Thromb. Haemost. 2012; 10 (7): 1320-1325.
6. Rodger M.A. An update on thrombophilia and placenta mediated pregnancy complications: What should we tell our patients? Thromb. Res. 2013; 131 (1): 25-27.
References:
1. Thrombohemorrhagic complications in obstetric practice: A guide for physicians. Ed. AD Makatsaria [Trombogemorragicheskie oslozhneniya v akushersko-ginekologicheskoi praktike: Rukovodstvo dlya vrachei. Pod red. A.D. Makatsarii]. Moscow. 2011; 1056 s.
2. Samburova N.V. The clinical significance of monitoring blood coagulation activation markers during antithrombotic therapy in pregnancy, childbirth and postpartum women with thrombophilia Phd. Diss. [Klinicheskoe znachenie kontrolya markerov aktivatsii svertyvaniya krovi pri provedenii protivotromboticheskoi terapii u beremennykh, rozhenits i rodilnits s trombofiliei: dis....kand. med. nauk]. Moscow. 2008; 132 s.
3. Kovac M., Mitic G. et al. Thrombophilia in women with pregnancy-associated complications: fetal loss and pregnancy-related venous thromboembolism. Gynecol. Obstet. Invest. 2010; 69 (4): 233-8.
4. Kupferminc M.J. Thrombophilia and pregnancy. Reprod. Biol. Endocrinol. 2003;
1: 111.
5. Lykke J.A., Bare L.A., Olsen J. et al. Thrombophilias and adverse pregnancy outcomes: results from the Danish National Birth Cohort. J. Thromb. Haemost. 2012; 10 (7): 1320-1325.
6. Rodger M.A. An update on thrombophilia and placenta mediated pregnancy complications: What should we tell our patients? Thromb. Res. 2013; 131 (1): 25-27.
THROMBOPHILIA MARKERS AT WOMEN PATIENTS WITH HISTORY OF FETO-MATERNAL DISEASE AND THROMBOPHILIA
Andreeva M.D.
Kuban State Medical University, Ministry of Health of Russia, Moscow
Summary
The level of molecular markers of a thrombophilia (TAT, D-dimer) and platelet aggregate formation activity allows to estimate risk of obstetric complications at patients with the complicated pregnancy in the anamnesis and a thrombophilia. We observed 63 pregnant women (pregnancy term from 6 to 13 weeks) and 86 women planning pregnancy from which at 54 there was a preeclampsia in the anamnesis at 43 – a premature detachment of placenta, at 52 – antenatal fetal death. 53.0% patients with the complicated pregnancy in the anamnesis had high D-dimer; TAT – 55.0%; aggregation activity of platelets – 59.7%. High level of molecular markers of a thrombophilia are the indication to application the antithrombotic therapy and allow to control efficiency of this therapy.
Key words
Acquired and genetic thrombophilia, pre-eclampsia, antiphospholipid syndrome.
Received: 10.01.2015; in the revised form: 12.02.2015; accepted: 09.03.2015.
Conflict of interests
The author declared that they do not have anything to disclosure regarding funding or conflict of interests with respect to this manuscript.
For citation
Andreeva M.D. Thrombophilia markers at women patients with history of feto-maternal disease and thrombophilia. Akusherstvo, ginekologiya i reproduktsiya / Obstetrics, gynecology and reproduction. 2015; 1: 63-67 (in Russian).
|
|