ВОЗМОЖНОСТИ ВОССТАНОВЛЕНИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ У БОЛЬНЫХ С СОЧЕТАННОЙ ФОРМОЙ ГИПЕРАНДРОГЕНИИ
Саидова Р.А., Монастырная О.А., Давудова А.Г. Дата публикации на сайте: 2015-06-04 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Сочетанная форма гиперандрогении является одной из ведущих патогенетических причин развития нарушений менструальной и репродуктивной функций организма. Состояние ановуляции обуславливает повышение уровня основных андрогенов, а недостаточность лютеиновой фазы является следствием негативного влияния гиперандрогении. Проведение индивидуальной, патогенетически-обоснованной терапии с учетом состояния репродуктивной системы позволяет добиться восстановления овуляторных циклов и наступления беременности на фоне нормализации показателей метаболизма андрогенов и других показателей функционирования репродуктивной системы.
ABILITY TO RESTORE REPRODUCTIVE SYSTEM IN PATHINTS WITH COMBINED FORM OF HYPERANDROGENISM
Saidova R.A., Monastyrnaya O.A., Davudova A.G.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Summary
Combined form of hyperandrogenism is one of the leading pathogenic causes of menstrual and reproductive disfunctions. Anovulation state causes an increase in the level of the main androgens, and the luteal phase deficiency is a consequence of the negative impact of hyperandrogenism. Conducting individual pathogenesis-based therapy, taking into account the condition of the reproductive system, allows of ovulation and pregnancy on the background normalization of androgen metabolism and other indicators of the functioning of the reproductive system.
Key words Hyperandrogenism, аnovulation, luteal phase deficiency, polycystic ovary syndrome, testosterone, dihydrotestosterone, infertility.
Ключевые слова: гиперандрогения, ановуляция, НЛФ, поликистозные яичники, тестостерон, дигидротестостерон, бесплодие.
ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава России, Москва
DOI: 10.17749/2313-7347.2015.9.1.044-052
Статья поступила: 05.02.2015 г.; в доработанном виде: 16.02.2015 г.; принята к печати: 02.03.2015 г.
Конфликт интересов
Авторы заявляют об отсутствии необходимости раскрытия финансовой поддержки или конфликта интересов в отношении данной публикации.
Все авторы сделали эквивалентный вклад в подготовку публикации.
Для цитирования
Саидова Р.А., Монастырная О.А., Давудова А.Г. Возможности восстановления репродуктивной системы у больных с сочетанной формой гиперандрогении. Акушерство, гинекология и репродукция. 2015; 1: 44-52.
Введение
Одной из актуальных проблем современной гинекологической эндокринологии является раннее выявление нарушений репродуктивной функции у женщин в популяции.
Гиперандрогения (ГА) является одной из ведущих причин патологии репродуктивной системы, которую выявляют у 10-20% женщин репродуктивного возраста.
Частота ГА в структуре гинекологических заболеваний составляет 1,3-4% [4,10,11,18]. В литературе приведено множество определений понятия «гиперандрогения», но чаще всего этим термином обозначают симптомокомплекс нарушений в сфере специфических и метаболических эффектов андрогенов в женском организме, обусловленных патологией биосинтеза, транспорта и метаболизма андрогенов [2,5,16,17]. Синдром гиперандрогении является одним из наиболее частых причин нарушения репродуктивной системы женщины – олигоменореи, ановуляции и, как следствие, развития бесплодия [12,10]. Кроме того, ГА проявляется совокупностью признаков поражения кожи и ее придатков (гирсутизм, акне, алопеция, себорея), характеризующихся термином «андрогензависимая дермопатия» [1,4,21]. Известно, что андрогены в женском организме имеют два основных источника – яичники и надпочечники [11,20]. Выявление источника ГА представляет значительные трудности, диагностика конкретной клинической формы гиперандрогении сложна, что обусловлено полиморфизмом изучаемой патологии, преобладанием сочетанных форм. Между тем, выделение конкретной формы ГА, безусловно, важно для установления источника ГА и назначения адекватной, патогенетически обусловленной терапии [1,10,13]. На сегодняшний день наиболее популярной патологией, приводящей к развитию гиперандрогенного состояния, принято считать СПКЯ – синдром поликистозных яичников. СПКЯ рассматривают как полигландулярную, полиэтиологическую и полисимптомную патологию, патогенез которой может быть обусловлен как нарушениями в центральных отделах, так и в периферических звеньях РС [8,12]. В исследованиях многих авторов установлено, что около 10% женщин с СПКЯ имеют и проявления ВДКН [1,6,14]. Следует признать, что постоянно растущий интерес к изучению данной патологии ограничивают определенные трудности, к числу которых относятся гетерогенность, полиморфизм ГА, что приводит к существенным различиям диагностических подходов, трактовки результатов обследования, интерпретации клинических проявлений, особенностей течения заболевания и определения лечебной тактики. До настоящего времени остается дисскутабельным вопрос о взаимных влияниях состояния ГА женского организма и нарушений репродуктивной системы.
Вышеизложенное подтверждает актуальность проблемы, убеждает в необходимости совершенствования методов обследования больных с ГА, поиска оптимальных диагностических критериев, позволяющих точно выделить форму гиперандрогении, что, безусловно, важно для назначения эффективной, патогенетической терапии.
Цель исследования – проведение комплексной оценки состояния репродуктивной системы и совершенствование принципов восстановления менструальной и генеративной функции у больных с сочетанной формой гиперандрогении.
Материалы и методы
В работе представлены результаты обследования и лечения 105 женщин, включая группу контроля, в возрасте от 19 до 37 лет (средний возраст – 27,39±0,75 лет), из которых 70 пациенток были с проявлениями андрогензависимой дермопатии; с лабораторными признаками ГА – повышение тестостерона общего и свободного, андростендиона и дигидротестостерона. Выявление сочетанной ГА, которая имеет признаки, как надпочечниковой ГА (повышение ДГЭА-С, 17-ОНР и снижение кортизола), так и яичниковой гиперандрогении (ЛГ >10мЕд/мл, ЛГ/ФСГ >2, объем яичников >9 см3, опсоменорея и первичное бесплодие).
При отборе больных в исследуемых группах исключали:
– заболевания щитовидной железы;
– гиперпролактинемию;
– болезнь Иценко-Кушинга;
– тяжелые экстрагенитальные заболевания;
– гормональноактивные андрогенпродуцирующие опухоли яичников и надпочечников;
– патологию системы гемостаза (генетические и приобретенные формы тромбофилии).
Оценка состояния проводилась согласно критериям диагностики гиперандрогении по Р.А. Саидовой (2002):
– На первом этапе оцениваются клинические симптомы ГА – признаки андрогензависимой дермопатии разной степени выраженности – акне, гирустизм, алопеция и прочие;
– На втором этапе оцениваются лабораторные критерии ГА – повышение основных андрогенов – тестостерона общего, тестостерона свободного, андростендиона и дигидротестостерона;
– На третьем этапе проводится дифференциальная диагностика источника ГА – надпочечниковая, яичниковая или сочетанная ГА.
Оценка репродуктивной функции при СГА проводилась по состоянию на 5-7-й и 21-23-й дни менструального цикла, что позволило распределить больных на две группы, в зависимости от формы нарушения РС:
I группа СГА+А – 33 пациентки в возрасте от 19 до 37 лет (средний возраст 26,67±1,01лет), с ановуляторной формой нарушения репродуктивной системы (менструальный цикл <21 или >35 дней, толщина эндометрия – меньше 6 мм или больше 12 мм, отсутствие желтого тела в яичниках, концентрация прогестерона <15,9 нмоль/л на 21-23-й день менструального цикла).
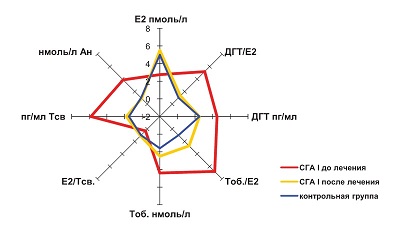 | Рисунок 1: Показатели стероидных гормонов и их соотношений в группе больных с СГА+Ановуляция до и после лечения на 21-23-й день цикла.
СГА – сочетанная гиперандрогения. |
II группа СГА+НЛФ – 37 пациенток в возрасте от 20 до 38 лет (средний возраст – 28,24±1,12 лет) с недостаточностью лютеиновой фазы (менструальный цикл – 21-26 дней, продолжительность фазы желтого тела – менее 10 дней, по УЗИ толщина эндометрия <10 мм и размеры желтого тела <20 мм, концентрация прогестерона – от 16 до 30 нмоль/л на 21-23-й день менструального цикла).
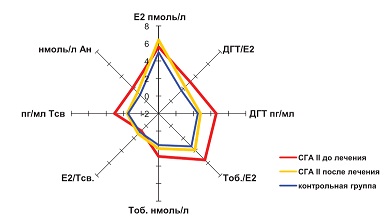 | Рисунок 2: Показатели стероидных гормонов и их соотношений в группе больных с СГА+НЛФ до и после лечения на 21-23-й день цикла.
СГА+НЛФ – сочетанная гиперандрогения + недостаточность лютеиновой фазы. |
Группу контроля составили 35 условно здоровых женщин репродуктивного возраста 28,32±1,52 лет с регулярным овуляторным менструальным циклом, длительностью 28-30 дней и без признаков ГА.
При изучении анамнестических данных и объективного обследования нами учитывались: возраст, состояние менструальной и репродуктивной функции, семейный анамнез, антропометрические данные, включая определение гирсутного числа по шкале Ferriman-Gallwey, данные УЗИ органов малого таза, гормональный и негормональный статус. Ультразвуковое исследование органов малого таза проводилось всем пациентам по стандартной методике в динамическом режиме, на аппарате Sono Ace – 8000 Live компании Medison (Корея), с использованием абдоминального и вагинального датчиков частотой соответственно 3,5 МГц, 5 МГц и 7,5 МГц. На 5-7-й день менструального цикла оценивались: размеры матки, объем яичников, толщина эндометрия, количество и размеры фолликулов, а также отмечалось наличие патологических образований; на 21-23-й день цикла определяли размеры желтого тела и М-эхо. Исследование гормонального профиля выполняли также в динамике менструального цикла на 5-7-й и 21-23-й дни, с оценкой уровней секреции пептидных (фолликулостимулирующего гормона (ФСГ), лютеинизирующего (ЛГ), пролактина) и стероидных половых гормонов: эстрадиола (Е2), прогестерона (Р), тестостерона общего (Тоб.) и свободного (Тсв), андростендиона (Ан), дигидротестостерона (ДГТ), 17-гидроксипрогестерона (17-ОНР), дегидроэпиандростерон-сульфата (ДГЭА-С), кортизола (К), а также ГСПГ (глобулина, связывающего половые стероидные гормоны). Кроме определения количественных показателей перечисленных гормонов учитывались качественные показатели соотношений Р/Е2, Тоб./Е2, ДГТ/Е2, Е2/Тсв., ЛГ/ФСГ. С целью исключения патологии щитовидной железы определяли уровни тиреоидных гормонов крови. Исследование негормонального гомеостаза проводилось всем пациенткам для выявления нарушений углеводного и липидного обмена. Исследование системы гемостаза выполнялось при первичном обследовании, а также в процессе лечения через 1-3-6 мес. и было направлено на диагностику тромбофилического состояния (АЧТВ, степень агрегации тромбоцитов с различными стимуляторами агрегации, РКМФ, Д-димер и комплексы ТАТ). Исследование проводилось иммуноферментным способом на спектро-фотометре Boehnringer ELISA-Photometr. Пациентам при наличии воспалительных заболеваний органов малого таза для уточнения диагноза проводились микробиологические методы исследования содержимого из заднего свода влагалища и цервикального канала шейки матки, с контролем через 3-4 нед. после лечения и далее в течение трех менструальных циклов.
С целью коррекции нарушений менструальной и генеративной функции, а также первым этапом стимуляции овуляции при СГА проводилась терапия комбинированными оральными контрацептивами (КОК), содержащими прогестагены. В качестве гормональной поддержки лютеиновой фазы менструального цикла назначали натуральный микронизированный прогестерон в суточной дозе 200-300 мг и аналог эндогенного прогестерона дидрогестерон в режиме 10-14 дней в дозе 10-20 мг в сут. С целью уменьшения проявлений андрогензависимой дермопатии, а также в качестве коррекции гормональных нарушений проводилась терапия дексаметазоном в индивидуальной дозе 0,125-0,5 мг в сут. Результаты лечения оценивались через 3-6-9 мес. лечения. Статистическая обработка полученных данных осуществлялась на компьютере с использованием параметрических и непараметрических методов при помощи пакета программ Microsoft Excel (Microsoft, США), «SPSS–9,0». Достоверными различия между группами больных принимались при значении р<0,05.
Результаты и их обсуждение
Согласно данным отечественной и мировой литературы оценивать состояние репродуктивной системы следует только после исключения тяжелых соматических, эндокринных и инфекционных заболеваний, которые зачастую являются причиной менструальной и репродуктивной дисфункции, поскольку адекватное функционирование всех уровней репродуктивной системы возможно лишь в условиях физического и психоэмоционального комфорта, то есть в условиях здорового женского организма. Определение только одного маркера – тестостерона общего не является, по-нашему мнению, достаточным критерием гиперандрогении (ГА), поэтому судить о наличии ГА правомерно только после одновременного исследования всех активных участников метаболизма андрогенов (Тоб., Тсв., Ан., ДГТ) в динамике менструального цикла в сочетании с клиническими данными и результатами оценки функционального состояния РС. Состояние ГА при исследовании на 5-7-й день менструального цикла может представляться более выраженным у больных с преобладанием яичникового компонента, так как определяется значительное повышение уровней основных андрогенов: Тоб. (3,75±0,31 нмоль/л, р<0,05), Тсв. (6,03±1,12 пг/мл, р<0,01) и Ан. (16,27±5,24 нмоль/л, р<0,01). При этом имеются относительно нормальные показатели уровня Е2=169,82±9,63 пмоль/л (р<0,05) и ДГТ=318,29±30,59 пг/мл (р<0,05), что делает реальную ГА менее значимой. Кроме того, ГА в группе с преобладанием яичникового компонента преимущественно и, прежде всего, обусловлена состоянием ановуляции, что подтверждается исследованиями, проведенными на 21-23-й день менструального цикла: уровень Р=2,32±0,41 нмоль/л, (р<0,01), а Е2=275,19±26,6 пмоль/л на 21-23-й и 169,82±9,63 пмоль/л, (р<0,05) на 5-7-й день менструального цикла. Значения основных андрогенов Тоб., Тсв., Ан и ДГТ оставались стабильно высокими, практически аналогичными результатам, полученным на 5-7-й день менструального цикла. Рассмотрев в отдельности показатели андрогенов и Е2, мы оценивали также их соотношения (Тоб./Е2, ДГТ/Е2 и Е2/Тсв.), которые значительно превышали значения женщин контрольной группы. При этом максимальное значение Тоб./Е2 определено в группе СГА+А – 23,75±1,46 в нмоль/л, (р<0,05). Соотношение Е2/Тсв. было достоверно низким как в группе с СГА+А – 16,27±5,24 (р<0,01), так и в группе с СГА+НЛФ – 14,15±1,43 (р<0,01), однако причины столь низкой величины Е2/Тсв. были различны: в группе с СГА+А – вследствие выраженного повышения Тсв., а в группе с СГА+НЛФ – ввиду состояния гипоэстрогении на 5-7-й день менструального цикла. Полученные результаты согласуются с мнением ряда ученых [5,9,11], рассматривающих гипотезу о роли адренархе в генезе яичниковой ГА, которая исходит из допущения о чрезмерной стимуляции сетчатой зоны коры надпочечников, приводящей к усилению секреции андрогенов и, как следствие, к экстрагландуларному образованию эстрогенов. Последнее, в свою очередь, обуславливает рост ЛГ/ФСГ и сопутствующее усиление секреции андрогенов яичниками.
Повышенные уровни андрогенов являются результатом ановуляции, при этом прогрессирующее увеличение половых стероидов усугубляет ановуляторное состояние, что проявляется повышением величины ЛГ (9,12±0,76 мЕд/мл, р<0,01) и соотношения ЛГ/ФСГ (1,61±0,13, р<0,05), которое двукратно увеличивается до 2,99±0,32 (р<0,01) в динамике менструального цикла. У больных с СГА+А определяются в 69,2% наблюдений увеличенные в объеме яичники (14,23±1,16 см3, р<0,01), а фолликулярный аппарат на 5-7-й день менструального цикла представлен фолликулами диаметром от 8 до 10 мм (в среднем 8,37±0,62 мм), которые в равной степени секретируют как эстрогены, так и андрогены, поддерживая нормоэстрогенное ановуляторное состояние [6,14,15]. Клинические проявления нарушения состояния РС в группе больных СГА+А проявляются значительными нарушениями функции – менструальной (опсоменорея – 60,6% и аменорея – 9,1%) и репродуктивной (бесплодие – 72,9%).
Для лечения больных с СГА+А нами была использована в качестве стартовой наиболее простая схема стимуляции овуляции современными метаболически нейтральными КОК или КОК, которые не являются производными 19-норстероидов, поскольку у пациенток с СГА применение данных препаратов усугубляет состояние ГА. Применение КОК, содержащих такие прогестагены, как диеногест и дроспиренон, позволяет на только снизить функциональную активность яичников и уровень ЛГ за счет восстановления центрального звена регуляции репродуктивной системы, но и не оказывать негативного влияния на общий метаболизм и метаболизм андрогенов в целом. Продолжительность лечения определяется в каждом клиническом наблюдении индивидуально, и, в первую очередь, нормализацией показателей метаболизма андрогенов и состояния органов репродуктивной системы, а также снижением уровня ЛГ и соотношения ЛГ/ФСГ в первые три месяца проведения терапии. При наличии неполного эффекта данного вида терапии продолжительность курса должна составлять не менее 4-6 мес.
Таким образом, на фоне терапии значительно снизились показатели основных андрогенов: Тоб. (2,16±0,24 нмоль/л, р<0,01), Тсв. (1,03±0,29 пг/мл, р<0,01), Ан (6,37±0,42 нмоль/л, р<0,05) и ДГТ (210,32±22,57 пг/л, р<0,05), которые практически соответствовали значениям женщин в контрольной группе. В связи с нормализацией центрального звена регуляции РС и восстановления функционально активных овуляторных менструальных циклов наблюдалось значительное увеличение показателя Е2=547,24±55,38 пмоль/л, (р<0,05) на 21-23-й день менструального цикла и достоверное снижение соотношений: Тоб./Е2=10,86±1,79 (р<0,05), ДГТ/Е2=4,82±1,43 (р<0,05). Снижение уровня концентрации ЛГ 5,19±1,12 мЕд/мл и значений соотношения ЛГ/ФСГ 0,97±0,21 (р<0,05), которые коррелировали с уменьшением концентрации тестостерона и объема яичников (8,79±1,34 см3, р<0,05) вследствие подавления ЛГ-зависимого синтеза андрогенов. Кроме того, была обнаружена сильная прямая корреляционная связь ЛГ с величиной объема яичников и уровнем андростендиона.
При восстановлении овуляторных циклов пациентам с ановуляцией на фоне СГА показано продолжение терапии, аналогичной больным с НЛФ, для нормализации функциональной активности желтого тела и показателей нарушенного метаболизма андрогенов, поскольку, по результатам нашего исследования, часть пациенток с СГА+А переходили в группу СГА+НЛФ (78,6%). Кроме того, на фоне терапии в группе СГА+А значительно снизилась частота НМФ, при этом наиболее тяжелая форма дисфункции – аменорея – после лечения отсутствовала у всех пациенток (до лечения составляла 9,1%). Проявления опсоменореи уменьшились до 12,4%. В случае подготовки женщины к беременности и лечения бесплодия терапия продолжается до наступления беременности. Характеристика показателей фертильности пациенток после лечения в данной группе СГА проявлялась наступлением беременности у 66,7% пациенток, при этом средняя продолжительность терапии составила 7,62±0,64 мес.
У больных с НЛФ при СГА преимущественным звеном является нарушение стероидогенеза в надпочечниках. Повышение функциональной активности надпочечникового звена создает видимость невыраженной ГА, что проявляется незначительным увеличением показателей основных андрогенов: Тоб. (2,97±0,26 нмоль/л, р<0,05), Тсв. (3,21±0,18пг/мл, р<0,05), Ан. (10,67±0,53 нмоль/л, р<0,05) и выраженным повышением уровня ДГТ (448,17±11,49 пг/мл, р<0,01), имеющего тенденцию к росту в динамике менструального цикла ДГТ (458,52±20,29 пг/мл).
Состояние ГА оказывает угнетающее влияние на процессы роста и развития фолликулов в яичниках, что обуславливает уменьшение размеров преовуляторного фолликула до 16,84±0,74 мм, (р<0,05) на 11-15-й день менструального цикла, сдвиг овуляции (16-18-й день менструального цикла), низкую функциональную активность желтого тела – 17,53±0,57 мм, (р<0,05), и изменение гормональных параметром (снижение уровня Е2 на 5-7-й день менструального цикла – 157,77±16,12 пмоль/л (р<0,05) и значения Р на 21-23-й день менструального цикла до 31,79±2,27 нмоль/л, (р<0,01). Так как у больных с НЛФ определено преобладание надпочечникового компонента ГА, закономерно оценить показатели предшественников половых стероидов: ДГЭА-С и 17-ОНР, которые достоверно превышали значения больных СГА+А. Итак, согласно результатам исследования уровень ДГЭА-С составлял 7,19±0,87 мкмоль/л (р<0,01), а показатель 17-ОНР – 5,76±0,24 нмоль/л, который в динамике менструального цикла увеличился до 10,98±1,46 нмоль/л (р<0,01). Почти двукратное повышение 17-ОНР на протяжении менструального цикла обусловлено, по нашему мнению, повышением концентрации прогестерона на 21-23-й день менструального цикла, который активно секретируется желтым телом, становясь в итоге звеном метаболизма цепочки андрогенов. Кроме того, для больных с СГА+НЛФ характерны незначительные нарушения функций репродуктивной системы – менструальной функции в виде дисменореи у 29,7%, ПМС – у 53% и метроррагии – у 43% больных, каковые являются клиническими критериями НЛФ.
Е2 относится к наиболее биологически активным соединениям, его показатель является основным критерием, определяющим функциональную активность женской репродуктивной системы [4,8]. Этот факт подтверждают результаты нашего исследования, в котором у больных с СГА+НЛФ выявлено гипоэстрогенное состояние (157,77±16,12 пмоль/л) на 5-7-й день менструального цикла, усугубляющее состояние ГА. Низкий уровень Е2 у больных с СГА+НЛФ обуславливает высокие показатели соотношений андрогенов с эстрогенами, что клинически проявляется выраженными кожными признаками реальной ГА (акне – 43%, гирсутизм=11,43±0,65 баллов). Результаты исследования соотношений на 5-7-й день менструального цикла в группе с СГА+НЛФ характеризовались более высокими значениями соотношения ДГТ/Е2=10,51±1,02 (р<0,01) по сравнению с группой СГА+А ДГТ/Е2=9,49±0,77, который значительно снижался во второй группе (до 3,12±0,28, р<0,01) и оставался неизменным показателем в первой группе (8,87±1,78, р<0,01) в динамике менструального цикла. Самым низким показателем значения соотношения Е2/Тсв.=14,15±1,43 по отношению к данным группы контроля (39,57±2,08, р<0,01). Показатель Тоб./Е2 составил 21,46±3,42 в нмоль/л, что практически аналогично группе СГА+А и достоверно выше уровня показателей контрольной группы – 6,74±0,38 (р<0,01). Следует отметить, что в динамике менструального цикла происходило почти двукратное снижение данных значений вследствие выраженного увеличения показателя Е2=559,28±37,84 пмоль/л (р<0,01).
У больных с НЛФ выявлена высокая частота случаев репродуктивных потерь 32,4%, которая обусловлена невынашиванием беременности (НБ) у каждой четвертой пациентки, протекающей по типу неразвивающейся беременности до 8-9-й нед. гестации. Общеизвестно, что данное состояние связано с низкой функциональной активностью желтого тела, при этом хорионический гонадотропин, важной задачей которого является предотвращение регрессии и стимулирование работы желтого тела, начинает оказывать свое влияние только с 12-14-го дня после оплодотворения [9,16,17]. Данное высказывание подтверждает необходимость назначения терапии прогестагенами с целью восстановления функциональной активности желтого тела и, как следствие, сохранения желанной беременности. Положительный эффект данной схемы лечения заключается в следующем: нормализации фолликулогенеза в яичниках, который проявляется увеличением размеров преовуляторного фолликула (20,97±1,32 мм, р<0,05) и появлением функционально-активного желтого тела (21,36±0,78 мм, р<0,05), повышением уровня Е2 (219,54±25,53 пмоль/л, р<0,05) на 5-7-й день менструального цикла и показателя Р (44,73±4,28 нмоль/л, р<0,05) на 21-23-й день менструального цикла, а также наступлением беременности (68,4%).
Согласно полученным результатам исследования на фоне проводимой патогенетической терапии у больных с СГА+НЛФ происходило достоверное снижение показателей андрогенов и выраженное повышение уровня Е2=219,54±25,53 пмоль/л на 5-7-й и 630,33±53,54 пмоль/л на 21-23-й дни менструального цикла, что практически соответствовало уровню здоровых, негирсутных женщин в популяции. Показатель Тоб. снизился до 2,21±0,18 нмоль/л (р<0,05); уровень Тсв. составил 1,14±0,16 пг/мл, (р<0,01); Ан уменьшился и соответствовал 6,32±0,83 нмоль/л, (р<0,05); значение ДГТ достоверно снизилось до 292,57±17,42 пмг/мл, (р<0,05), но оставалось выше общепопуляционных показателей. Учитывая значительное увеличение уровня Е2 и достоверное снижение показателей андрогенов, отмечалось также снижение соотношений Тоб./Е2 и ДГТ/Е2, что клинически проявлялось улучшением состояния кожи (акне – у 22,3% больных и степень выраженности гирсутизма – 9,46±1,17 баллов).
Пациенты c недостаточностью лютеиновой фазы нуждаются в индивидуальной коррекции гиперандрогенного состояния в комбинации с прогестагенами, аналогами натурального прогестерона, по общепринятой схеме лечения НЛФ. Основным подтверждением данного положения является тот факт, что у больных с ГА и бесплодием выявлялись как эпизоды с отсроченной овуляцией (средняя продолжительность менструального цикла – 40,15±3,79 дней), так и синдрома неовулировавшего фолликула, диагностика которого возможна лишь при проведении ультразвукового мониторинга фолликулогенеза. Положительный эффект данной схемы лечения заключается в следующих процессах: нормализации фолликулогенеза в яичниках, а именно – в увеличении преовуляторного фолликула, появлении функционально-активного желтого тела, повышении уровня Е2 на 5-7-й день менструального цикла и показателя Р – на 21-23-й день менструального цикла (83,8%), а также в наступлении беременности (68,4%). В группе СГА+НЛФ на фоне проводимой патогенетической терапии происходило достоверное снижение следующих показателей: Тоб., Тсв., Ан. и ДГТ, а также выраженное повышение уровня Е2 как на 5-7-й так и 21-23-й дни менструального цикла, что практически аналогично значению контрольной группы. С учетом значительного увеличения Е2 и снижения андрогенов нами было отмечено достоверное снижение показателей их соотношений, что клинически проявлялось улучшением состояния кожи.
По результатам нашего исследования, беременность наступала только в тех случаях, когда происходила нормализация всех показателей метаболизма андрогенов (Тобщ., Тсв., ДГТ и Ан.) и соотношений с эстрогенами (Тобщ./Е2, ДГТ/Е2) в фертильном цикле. На ранних сроках беременности (5-8-я нед. гестации) сохранение беременности возможно только при снижении уровней андрогенов при динамически возрастающих концентрациях эстрадиола и ХГЧ.
Таким образом, следует отметить, что проведение гормональной коррекции диагностированных нарушений репродуктивной функции в обеих группах СГА,
с учетом показателей метаболизма андрогенов и изменений в системе гемостаза, позволяют достичь нормализации значений гормонального профиля, менструальной функции, а также стойкого восстановления функционального состояния репродуктивной системы.
Заключение
Для больных с СГА+А характерны выраженные нарушения менструальной (опсоменорея, с эпизодами задержки менструации до двух месяцев и/или аменорея) и репродуктивной (бесплодие эндокринное) функции; увеличение объема яичников >9 см3; повышение значения коэффициента ЛГ/ФСГ >2 и показателей основных андрогенов (Тоб., Тсв., Ан.). Уровни андрогенов у пациенток с ановуляцией значительно отличались от значений андрогенов группы контроля как на 5-7-й, так и на 21-23-й дни менструального цикла, при этом показатель Е2 в динамике менструального цикла статистически значимо не менялся, что в сочетании с низким уровнем прогестерона подтверждает ановуляторное состояние.
Повышенные уровни андрогенов у пациенток с СГА+А являются результатом ановуляции, при этом прогрессирующее в динамике менструального цикла увеличение половых стероидов усугубляет ановуляторное состояние, что проявляется повышением уровня ЛГ и соотношения ЛГ/ФСГ, увеличением в объеме яичников, с фолликулами диаметром от 8 до 10 мм и отсутствием динамических изменений величины Е2 и показателя Р.
Для больных с СГА+НЛФ характерны незначительные нарушения менструального цикла (отсроченная овуляция); невынашивание беременности, обусловленное снижением функциональной активности желтого тела и изменением гормональных параметров (снижением уровня Е2=157,77±16,12 пмоль/л на 5-7-й день менструального цикла и Р на 21-23-й день менструального цикла – 31,79 нмоль/л), а также выраженным состоянием гиперандрогении. У пациентов с НЛФ показатели андрогенов при исследовании на 5-7-й день менструального цикла были практически аналогичны значениям группы с ановуляцией (Тобщ., Тсв., Ан., ДГТ), однако в динамике менструального цикла их показатели приблизились к значениям группы контроля, а уровни эстрадиола и прогестерона двукратно увеличились, что свидетельствует о наличии овуляторного цикла.
Состояние гиперандрогении у больных с СГА+НЛФ оказывает угнетающее влияние на процессы роста и развития фолликулов в яичниках, что обуславливает у таких пациенток уменьшение размеров преовуляторного фолликула, сдвиг овуляции, низкую функциональную активность желтого тела, а также изменение гормональных параметров (снижение уровня Е2 на 5-7-й день менструального цикла и значения Р на 21-23-й день менструального цикла).
Эффективность проведения терапии, направленной на восстановление функций репродуктивной системы женщин с ГА, зависит от точности дифференциальной диагностики характера ГА и состояния репродуктивной системы.
Литература:
1. Арутюнян Э.М. Основные принципы диагностики и гормональной коррекции надпочечниковой гиперандрогении у больных с врожденной дисфункцией коры надпочечников. Дис. …канд. мед. наук. М. 2009; 122.
2. Вихляева Е.М. Руководство по гинекологической эндокринологии. М. 1997.
3. Воробьева Е.В. Оценка состояния репродуктивной системы в оптимизации принципов лечения эндокринных форм бесплодия у женщин позднего репродуктивного возраста. Дис. …канд. мед. наук. М. 2012; 187.
4. Доброхотова Ю.Э., Джобава Э.М., Рагимова З.Э., Герасимович М.Ю. Синдром гиперандрогении в практике акушера-гинеколога, дерматолога и эндокринолога. М. 2009; 23-39.
5. Дуринян Э.Р. Стероидогенез в надпочечниках при синдроме поликистозных яичников. Проблемы репродукции. 1997; 3: 18-22.
6. Гусейнова З.С. Особенности профилактики синдрома потери плода у беременных с гиперандрогенией. Дис. …канд. мед. наук. М. 2011; 186.
7. Исламова Ш.Н. Основные принципы дифференциальной диагностики и тактики ведения больных с сочетанной формой гиперандрогении. Дис. …канд. мед. наук. М. 2011; 119.
8. Кулаков В.И., Назаренко Т.А., Кузмичев Л.Н. и др. Сравнительная оценка методов лечения бесплодия у женщин с СПКЯ. Журнал рос. акушера и гинеколога. 2004; 1: 23-28.
9. Назаренко Т.А. Женское бесплодие, обусловленное нарушениями процесса овуляции: клиника, диагностика и лечение. Автореф. дис. … докт. мед. наук. М. 1998; 42.
10. Манухин И.Б., Тумилович Л.Г., Геворкян М.А. Клинические лекции по гинекологической эндокринологии. М. 2006; 174-189.
11. Овсянникова Т.В., Фанченко Н.Д., Сперанская Н.В., Глазкова О.И. Особенности функции коры надпочечников у больных с хронической ановуляцией и гиперандрогенией. Проблемы репродукции. 2001; 1: 30-35.
12. Першина Е.В. Оценка и принципы коррекции нарушений репродуктивной системы у больных с сочетанной формой гиперандрогении. Дис. …канд. мед. наук. М. 2011; 162.
13. Саидова Р.А., Арутюнян Э.М., Першина Е.В., Мамардашвили Р.Т., Исламова Ш.Н. Основные принципы лечения больных с различными формами гиперандрогении. Журнал Акушерства и женских болезней. 2009; 1: 84-91.
14. Саидова Р.А., Макацария А.Д. Избранные лекции по гинекологии. М. 2005; 185-208.
15. Саидова Р.А., Воробьева Е.В., Монастырная О.А. Значение оценки состояния репродуктивной системы в лечении бесплодия женщин позднего репродуктивного возраста. Гинекология. 2012; 14 (2): 69-74.
16. Серов В.Н., Прилепская В.Н., Овсянникова Т.В. Гинекологическая эндокринология. М. 2006.
17. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. М. 2005; 224-262.
18. Чернуха Г.Е. Гиперандрогении и принципы их терапии у женщин репродуктивного возраста. Медицина. 2004; 3: 17-20.
19. Carmina E. Ovarian and adrenal hyperandrogenism. Ann. N Y Acad. Sci. 2006; 1092: 130-7.
20. Moran C, Azziz R. 21-hydroxylase-deficient nonclassic adrenal hyperplasia: the great pretender. Semin Reprod Med. 2003; 21: 295-300.
21. Rebora A. Pathogenesis of androgenetic alopecia. Journal of the American Academy of Dermatology. 2004; 50: 777-779.
References:
1. Arutyunyan E.M. Basic principles of diagnosis and correction of hormonal adrenal hyperandrogenism in patients with congenital adrenal hyperplasia Phd.diss. [Osnovnye printsipy diagnostiki i gormonalnoi korrektsii nadpochechnikovoi giperandrogenii u bolnykh s vrozhdennoi disfunktsiei kory nadpochechnikov. Dis. …kand. med. nauk]. Moscow. 2009; 122.
2. Vikhlyaeva E.M. Manual of Gynecological Endocrinology [Rukovodstvo po ginekologicheskoi endokrinologii]. Moscow. 1997.
3. Vorobeva E.V. Assessment of the state of the reproductive system in optimizing treatment principles of endocrine forms of infertility in women of late reproductive age. Phd.diss. [Otsenka sostoyaniya reproduktivnoi sistemy v optimizatsii printsipov lecheniya endokrinnykh form besplodiya u zhenshchin pozdnego reproduktivnogo vozrasta. Dis. …kand. med. nauk]. Moscow. 2012; 187.
4. Dobrokhotova Yu.E., Dzhobava E.M., Ragimova Z.E., Gerasimovich M.Yu. Syndrome of hyperandrogenism in practice an obstetrician-gynecologist, dermatologist and endocrinologist [Sindrom giperandrogenii v praktike akushera-ginekologa, dermatologa i endokrinologa]. Moscow. 2009; 23-39.
5. Durinyan E.R. Problemy reproduktsii. 1997; 3: 18-22.
6. Guseinova Z.S. Especially the prevention of fetal loss syndrome in pregnant women with hyperandrogenism Phd.diss. [Osobennosti profilaktiki sindroma poteri ploda u beremennykh s giperandrogeniei. Dis. …kand. med. nauk]. Moscow. 2011; 186.
7. Islamova Sh.N. Basic principles of differential diagnosis and management of patients with combined forms of hyperandrogenism Phd.diss. [Osnovnye printsipy differentsialnoi diagnostiki i taktiki vedeniya bolnykh s sochetannoi formoi giperandrogenii. Dis. …kand. med. nauk]. Moscow. 2011; 119.
8. Kulakov V.I., Nazarenko T.A., Kuzmichev L.N. i dr. Zhurnal ros. akushera i ginekologa. 2004; 1: 23-28.
9. Nazarenko T.A. Female infertility due to ovulation disorders: clinical features, diagnosis and treatment Phd.diss. [Zhenskoe besplodie, obuslovlennoe narusheniyami protsessa ovulyatsii: klinika, diagnostika i lechenie. Avtoref. dis. … dokt. med. nauk]. Moscow. 1998; 42.
10. Manukhin I.B., Tumilovich L.G., Gevorkyan M.A. Clinical lectures on gynecological endocrinology [Klinicheskie lektsii po ginekologicheskoi endokrinologii]. Moscow. 2006; 174-189.
11. Ovsyannikova T.V., Fanchenko N.D., Speranskaya N.V., Glazkova O.I. Problemy reproduktsii. 2001; 1: 30-35.
12. Pershina E.V. Evaluation and correction of violations of the principles of the reproductive system in patients with concomitant form of hyperandrogenism Phd.diss. [Otsenka i printsipy korrektsii narushenii reproduktivnoi sistemy u bolnykh s sochetannoi formoi giperandrogenii. Dis. …kand. med. nauk]. Moscow. 2011; 162.
13. Saidova R.A., Arutyunyan E.M., Pershina E.V., Mamardashvili R.T., Islamova Sh.N. Zhurnal Akusherstva i zhenskikh boleznei. 2009; 1: 84-91.
14. Saidova R.A., Makatsariya A.D. Selected lectures on gynecology [Izbrannye lektsii po ginekologii]. Moscow. 2005; 185-208.
15. Saidova R.A., Vorobeva E.V., Monastyrnaya O.A. Ginekologiya. 2012; 14 (2): 69-74.
16. Serov V.N., Prilepskaya V.N., Ovsyannikova T.V. Gynecological endocrinology [Ginekologicheskaya endokrinologiya]. Moscow. 2006.
17. Smetnik V.P., Tumilovich L.G. Non-immediate gynecology [Neoperativnaya ginekologiya]. Moscow. 2005; 224-262.
18. Chernukha G.E. Meditsina. 2004; 3: 17-20.
19. Carmina E. Ovarian and adrenal hyperandrogenism. Ann. N Y Acad. Sci. 2006; 1092: 130-7.
20. Moran C, Azziz R. 21-hydroxylase-deficient nonclassic adrenal hyperplasia: the great pretender. Semin Reprod Med. 2003; 21: 295-300.
21. Rebora A. Pathogenesis of androgenetic alopecia. Journal of the American Academy of Dermatology. 2004; 50: 777-779.
ABILITY TO RESTORE REPRODUCTIVE SYSTEM IN PATHINTS WITH COMBINED FORM OF HYPERANDROGENISM
Saidova R.A., Monastyrnaya O.A., Davudova A.G.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Summary
Combined form of hyperandrogenism is one of the leading pathogenic causes of menstrual and reproductive disfunctions. Anovulation state causes an increase in the level of the main androgens, and the luteal phase deficiency is a consequence of the negative impact of hyperandrogenism. Conducting individual pathogenesis-based therapy, taking into account the condition of the reproductive system, allows of ovulation and pregnancy on the background normalization of androgen metabolism and other indicators of the functioning of the reproductive system.
Key words
Hyperandrogenism, аnovulation, luteal phase deficiency, polycystic ovary syndrome, testosterone, dihydrotestosterone, infertility.
Received: 05.02.2015; in the revised form: 16.02.2015; accepted: 02.03.2015.
Conflict of interests
The authors declared that they do not have anything to disclosure regarding funding or conflict of interests with respect to this manuscript.
All authors contributed equally to this article.
For citation
Saidova R.A., Monastyrnaya O.A., Davudova A.G. Ability to restore reproductive system in pathints with combined form of hyperandrogenism. Akusherstvo, ginekologiya i reproduktsiya/Obstetrics, gynecology and reproduction. 2015; 1: 44-52 (in Russian).
|
|