ЗНАЧЕНИЕ ИММУНОМОДУЛИРУЮЩЕЙ ТЕРАПИИ ПРИ ПРЕГРАВИДАРНОЙ ПОДГОТОВКЕ ПАЦИЕНТОК С РЕЦИДИВИРУЮЩИМ ВПГ 2-ГО ТИПА
Минаев Н.Н., Бугримов Д.Ю., Климович А.А. Дата публикации на сайте: 2015-06-04 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Вирус простого герпеса типа 1 (ВПГ-1) и 2 (ВПГ-2) – широко распространенные вирусы, способные формировать пожизненную инфекцию и персистенцию. Генитальный герпес у женщин детородного возраста представляет собой серьезный риск вертикальной передачи инфекции от матери к плоду. Первичные ВПГ-инфекции и первые клинические эпизоды генитальной ВПГ-инфекции представляют особенно высокий риск инфицирования плода и новорожденного. Заражение редко происходит в полости матки, чаще всего вирус передается во время родов. Наибольший риск передачи инфекции плоду и новорожденному имеет место в случае первичной материнской инфекции, наступившей во второй половине беременности. Риск передачи заболевания от матери плоду и новорожденному может быть уменьшен назначением противовирусных препаратов или, в конкретных случаях, выполнением кесарева сечения. Целью данной работы является предложение одной из возможных стратегий профилактики передачи вируса от инфицированной матери плоду.
The significance of immunomodulatory therapy in pregravidal preparation of the patients with recurrent HSV type 2
Minaev N.N.1, Bugrimov D.Ju.1, Klimovich A.A.2
1Voronezh State Medical Academy named after NN Burdenko Russian Ministry of Health
2Voronezh Regional Clinical Consultative and Diagnostic Center
Abstract: Herpes simplex virus type 1 (HSV-1) and 2 (HSV-2) – is a widespread viruses that can form a lifelong infection and persistence. Genital herpes in women of childbearing age is a serious risk of vertical transmission from mother to fetus. Primary HSV infection and the first episode of genital HSV infections are particularly high risk of infection of the fetus and newborn. The infection rarely occurs in the uterus. Most often the virus is transmitted during childbirth. The greatest risk of transmission to the fetus and the newborn in the case of primary maternal infection occurred during the second half of pregnancy. The risk of transmission from mother to fetus and newborn, can be reduced or the appointment of antiviral drugs, or in specific cases, caesarean section. The purpose of this paper is to propose a possible strategy to prevent transmission of the virus from an infected mother to the fetus.
Key words: recurrent HSV-2, pregravid preparation, maternal antibodies, Toll-like receptors 9, Ferrovir®.
Ключевые слова: рецидивирующий ВПГ 2, прегравидарная подготовка, материнские антитела, толлподобные рецепторы 9, Ферровир.
ГБОУ ВПО «Воронежская Государственная Медицинская Академия имени Н.Н. Бурденко» Минздрава России
DOI: 10.17749/2313-7347.2015.9.1.019-031
Статья поступила: 20.02.2015 г.; в доработанном виде: 24.02.2015 г.; принята к печати: 25.03.2015 г.
Конфликт интересов
Авторы заявляют об отсутствии необходимости раскрытия финансовой поддержки или конфликта интересов в отношении данной публикации.
Все авторы сделали эквивалентный вклад в подготовку публикации.
Для цитирования
Минаев Н.Н., Бугримов Д.Ю., Климович А.А. Значение иммуномодулирующей терапии при прегравидарной подготовке пациенток с рецидивирующим ВПГ 2-го типа. Акушерство, гинекология и репродукция. 2015; 1: 19-31.
Вирус простого герпеса 2 (ВПГ-2) классифицируется вместе с ВПГ-1 в подсемействе Alphaherpesvirinae и является одной из весьма распространенных инфекций, передаваемых половым путем во всем мире. Уровень распространенности этого вируса – от 15 до 20% в Европе и Соединенных Штатах, и до 90% в некоторых африканских популяциях Суб-Сахары [14].
Вирус простого герпеса (ВПГ) – это повсеместно распространенный, оболочечный, с двухнитевой ДНК вирус, принадлежащий к семейству герпесвирусов, передаваемый через слизистые оболочки и поврежденную кожу. Впоследствии он мигрирует в нервные ткани, где сохраняется в латентном состоянии. ВПГ 1-го типа (ВПГ-1) преобладает при орофациальных поражениях, и, как правило, персистирует в ганглиях тройничного нерва, в то время как ВПГ 2-го типа (ВПГ-2), наиболее часто встречается в пояснично-крестцовых ганглиях [9]. Тем не менее, этот второй серотип может встречаться и при поражении орофациальной области и половых органов. Изменения в сексуальном поведении молодых людей могут частично объяснить его высокую частоту встречаемости [9,16]. Отличительной особенностью ВПГ-2-инфекции является отсутствие болезненных поражений и у большинства серопозитивных пациентов заболевание протекает бессимптомно, поэтому они не знают о своем диагнозе [10,19].
Первичная инфекция развивается при контакте с вирусом у восприимчивых индивидов, не имеющих ВПГ-1- и ВПГ-2-антител [8].
Первый клинический эпизод у первично инфицированного индивида возникает, когда человек с имеющимися у него ВПГ-антителами против типа 1 или типа 2 впервые контактирует с противоположным типом ВПГ [8]. Благодаря защитной функции имеющихся антител системные симптомы во время таких эпизодов, как правило, короче и менее выражены [17].
Рецидивирующая инфекция развивается у пациентов, имеющих антитела против того же типа ВПГ, с которым они контактируют [9]. Она определяется, как эпизод герпетических высыпаний у женщины с гомологичными IgG к ВПГ соответствующего типа. Рецидивирующие инфекции наиболее часто встречаются в течение первых трех месяцев после первичной инфекции, особенно при ВПГ-2. Примерно у 15% всех беременных женщин, имеющих в анамнезе ВПГ-2, происходит рецидив инфекции к периоду родов. Острые поражения обычно длятся в течение 9 дней, а остаточные явления – около 4 дней. Вирусная нагрузка при рецидивах, как правило, ниже, чем при первичных поражениях, и снижается сразу после продромальной и ранней стадии вторичного клинического эпизода. Уровень IgG возвращается к первоначальному значению до разрешения инцидента [17].
Вертикальная передача ВПГ-2 может стать причиной поражения глаз, распространенных повреждений кожи, менингоэнцефалита, системных поражений внутренних органов или пороков развития плода [8].
В целом ВПГ-2 серопозитивные до беременности женщины имеют пониженный риск неонатальной передачи, приписываемый трансплацентарной миграции антител к плоду. Но женщины с повторным эпизодом герпеса при родах, как правило, должны быть родоразрешены путем кесарева сечения, чтобы предотвратить передачу инфекции новорожденному [13]. Серонегативные до беременности женщины с герпетической инфекцией имеют высокий риск вертикальной передачи ВПГ-2 и неонатальных осложнений [7]. Возраст матери моложе 21 года является фактором повышенного риска для вертикальной передачи заболевания [4].
Примерно в 5% всех случаев неонатальной герпетической инфекции происходит внутриутробная передача вируса. При первичной инфекции возникает транзиторная виремия. ВПГ-2 имеет выраженный потенциал гематогенного распространения к плаценте и плоду. Это может приводить к целому спектру патологий, характерных для инфекционного TORCH-комплекса (токсоплазмоз, краснуха, цитомегаловирус и вирус простого герпеса), таких как микроцефалия, микрофтальмия, внутричерепные кальцификации и хориоретинит [17].
Передача в родах составляет большинство случаев неонатального поражения и происходит при прохождении плода через инфицированные родовые пути. Применение скальп-электрода увеличивает риск передачи инфекции во время родов [4]. От 75 до 90% детей с неонатальным ВПГ рождаются от бессимптомно инфицированных матерей, которые не имеют в анамнезе эпизодов заболевания.
Частота передачи ВПГ-2 в родах зависит от клинического типа инфекционного процесса. Снижение показателя зафиксировано в присутствии защитных материнских антител, которые проникают через плаценту:
– первичная ВПГ-2-инфекция – частота передачи – 50%;
– первый клинический эпизод у первично инфицированных лиц с антителами к ВПГ – частота передачи – 33%;
– рецидивирующая или бессимптомная инфекция – частота передачи – 0-4%.
Общая частота неонатального заражения плода от бессимптомно инфицированных женщин с ВПГ-2 в лабораторном анамнезе составляет менее 4 на 10000, то есть 1% риска бессимптомного течения заболевания у матери, умноженный на 4% риска вертикальной передачи [17].
Таким образом, можно обобщить следующее:
– частота неонатального инфицирования является самой высокой у серонегативных женщин, что подтверждает важность материнских антител в предотвращении вертикальной передачи вируса;
– наличие у матери не только ВПГ-2-антител, но и ВПГ-1-антител уменьшает число новорожденных с ВПГ-2-инфекцией;
– число инфицированных новорожденных как с первичной, так и с рецидивирующей формой больше для ВПГ-1 по сравнению с ВПГ-2;
– кесарево сечение является защитным оперативным вмешательством для предотвращения неонатального инфицирования [17].
Диагностика ВПГ
1. Исследование ВПГ-культуры уже давно является стандартным критерием для диагностики герпетической инфекции, с чувствительностью в 70% и специфичностью почти в 100%. Окончательный ответ диагностики культуры может занять до семи дней. Чувствительность культурального теста связана с типом ВПГ и местом забора материала. Чувствительность теста является самой высокой в течение продрома и низкой – в периоде реконвалесценции, особенно при хроническом течении процесса. Чувствительность культурального теста ниже для ВПГ-2, чем ВПГ-1. У женщин с бессимптомным течением заболевания чувствительность максимальна, когда материал взят из канала шейки матки и с места рецидива, даже если поражение не визуализируется [17].
2. В настоящее время все более широкое применение для диагностики ВПГ имеет полимеразная цепная реакция (ПЦР), представляющая собой молекулярный тест, который удобен в применении и, в конечном итоге, может заменить исследование ВПГ-культуры в качестве стандарта критерия [5,6,18]. Как и культуральный тест, ПЦР может различать ВПГ-1 от ВПГ-2. Выполнение теста занимает примерно один день, и этот метод имеет потенциал для более оперативного обнаружения вируса, чем тест ВПГ-культуры. К сожалению, с помощью ПЦР нельзя различить активно реплицирующийся вирус простого герпеса от ДНК вируса, находящегося в латентном состоянии.
3. В случае бессимптомного течения герпесвирусной инфекции или когда результаты ПЦР-исследования вызывают сомнение дополнительную информацию может предоставить серологическое исследование антител к ВПГ. Типоспецифические антитела класса G к вирусу простого герпеса 1-го и 2-го типов свидетельствуют о предшествующей или текущей инфекции. Типоспецифические IgG сохраняются в течение всей жизни. Это явление называется серопозитивностью. Рецидивирующий герпес обычно протекает на фоне высоких показателей IgG, свидетельствующих о постоянной антигенной стимуляции организма [2,3,15].
Терапия
Ацикловир – наиболее часто назначаемый препарат при лечении ВПГ-инфекции. Он был доступен для клинического использования в течение почти трех десятилетий и продемонстрировал высокий уровень безопасности и эффективности в лечении всех форм герпетической инфекции – от легких, до крайне тяжелых, как у обычных пациентов, так и больных с ослабленным иммунным ответом, в т.ч. и у новорожденных. Ацикловир является аналогом дезоксигуанозина. После преимущественного поглощения инфицированными вирусом клетками он фосфорилируется вирус-ассоциированной тимидилкиназой. Затем происходит ди- и трифосфорилирование препарата, катализируемое ферментами инфицированных клеток. Образовавшийся ацикловиртрифосфат прекращает синтез вирусной ДНК путем ингибирования вирусной ДНК-полимеразы, играя роль терминатора синтеза цепи. Препарат действует избирательно на синтез вирусной ДНК. На репликацию ДНК клетки-хозяина (клетки человека) ацикловиртрифосфат практически не влияет.
Валацикловир – препарат второго поколения – идентичен ацикловиру, получен путем добавления боковой цепи сложного эфира, который увеличивает его биодоступность. После абсорбции в организме он превращается в ацикловир. Это позволяет получать высокий сывороточный уровень препарата при уменьшении частоты приема [17].
С учетом двух вышеуказанных обстоятельств можно заключить следующее: 1) частота неонатального инфицирования является самой высокой у серонегативных женщин, что подтверждает важность материнских антител в предотвращении вертикальной передачи вируса; 2) наличие у матери не только ВПГ-2-антител, но и присутствие ВПГ-1-антител способствует уменьшению числа новорожденных с ВПГ-2 инфекцией [17].
Мы предположили, что повышение титра типоспецифических IgG в крови планирующих беременность бессимптомно инфицированных или серонегативных женщин будет уменьшать вероятность вертикальной передачи вируса у пациенток с ВПГ-инфекцией. Такое повышение титра возможно при применении в прегравидарной подготовке отечественного препарата природного происхождения Ферровир®, действующим веществом которого является дезоксирибонуклеат натрия в комплексе с железом.
Ферровир® – противовирусный препарат с иммуномодулирующим и протективным действием. Ферровир® является агонистом толл-подобных рецепторов 9 (Toll-like reseptors 9, TLR 9, CD 289). Препарат содержит в своем составе олигонуклеотиды из ДНК лосося, в 50% случаев оканчивающиеся неметиллированными CpG мотивами, которые являются специфическими лигандами TLR 9. Toll-like reseptors 9 имеют внутриклеточную, точнее эндосомальную локализацию и экспрессируются моноцитами (макрофагами), плазмоцитоидными дендритными клетками и В-лимфоцитами. Стимулируемые Ферровиром через TLR 9 плазмоцитоидные дендритные клетки способны влиять на дифференцировку Th0 в Th2 (наивных Т-хелперов в Т-хелперы 2-го типа). Под влиянием Th2 происходит дифференцировка В-лимфоцитов в плазматические клетки, секретирующие IgG 2, IgG 4 [1]. Характерным и объяснимым оказался факт повышения авидности IgG, синтезируемых плазматическими клетками.
В пролиферирующих центробластах (активированных В-лимфоцитах) происходит процесс формирования дополнительного разнообразия антител в процессе соматической гипермутации в уже перестроенных V-генах иммуноглобулинов [11]. Таким образом, повышается авидность синтезируемых антител, несмотря на неспецифичность антигенной стимуляции В-лимфоцитов Ферровиром.
Логично предположить, что повышение в крови матери титра типоспецифических антител, проникающих через плацентарный барьер, обеспечит плоду необходимое их количество, для опсонизации вирусных антигенов и их последующего фагоцитоза клетками системы мононуклеарных фагоцитов (СМФ).
Целью исследования было показать, что увеличение титра типоспецифических IgG и повышение их авидности под влиянием препарата Ферровир® достоверно увеличивает частоту наступления беременности, и уменьшает количество абортов и преждевременных родов у женщин, инфицированных вирусом простого герпеса 1-го и/или 2-го серотипов.
Материалы и методы
В исследование была включена 101 пациентка репродуктивного возраста от 25 до 31 года с первичным, или рецидивирующим, или с единственным эпизодом генитального герпеса. Большая часть пациенток после окончания курса противовирусной терапии в течение 12 мес. успешно зачали, выносили плод и родили ребенка. Все больные имели лабораторные признаки инфицированности ВПГ 1-го или 2-го серотипа, которые были дважды подтверждены методом ПЦР путем исследования соскоба из цервикального канала на 5-7-й дни менструального цикла. Для установления формы протекания инфекционного процесса, а главное, для определения уровня серопозитивности больным был проведен серологический анализ крови с измерением уровня содержания типоспецифических IgG и степени их авидности. По показаниям им были выполнены ультразвуковое исследование органов малого таза, кольпоскопия, а также у всех пациенток были взяты мазки из цервикального канала на онкоцитологию и патогенную/условно-патогенную микрофлору.
Было осуществлено динамическое наблюдение за пациентками сразу после проведенной терапии, через 2 нед., через 1, 3, 6, 9 и 12 мес.
Основными критериями включения женщин в исследование было их инфицирование ВПГ-1 и/или 2-го серотипа и планирование ими беременности. Основными критериями исключения являлись следующие: факт приема пациенткой любых иммуномодуляторов в период менее шести месяцев до начала исследования, планирование женщиной беременности во время терапии Ферровиром, наличие у нее аутоиммунных заболеваний. Все участвующие в исследовании женщины подписали информированное согласие и были в состоянии, по нашему мнению, вести дневник самооценки и соблюдать требования протокола.
В течение всей проводимой работы оценивалась безопасность препарата Ферровир®, по критерию возникновения осложнений или нежелательных реакций. Отказ от участия в исследовании мог быть инициирован как пациенткой, так и исследователями, например, в случае вынужденного приема ею противовирусного или иммуномодулирующего препарата.
Статистическая обработка результатов была проведена методом вариационной статистики и корреляционного анализа с помощью программы Microsoft Excel 7,0 (Windows 7 Microsoft Office 2007), с определением критерия Стьюдента (t) для независимых групп.
Для оценки протективного действия противовирусного иммуномодулятора Ферровир® на инфицирование плода и привычной потери беременности и сравнения его с противоположным по патогенетическому действию противовирусным препаратом валацикловиром методом случайной выборки все ВПГ-инфицированные женщины, планирующие беременность (101 пациентка), были разделены на три репрезентативные группы:
– Группа сравнения (37 больных) получала стандартную терапию препаратом валацикловир в дозе 500 мг 2 раза в сут. в течение 7 дней;
– Первая исследуемая группа (32 больных) получала терапию препаратом Ферровир®, раствор для внутримышечного введения 15 мг/мл. Способ применения препарата Ферровир® заключался во внутримышечном введении раствора по 5 мл (75 мг) 1 раз в сут. через 24 ч в течение 10 дней, 10 инъекций на курс.
– Вторая исследуемая группа (32 больных) получала комплексную терапию препаратами валацикловир+Ферровир® в дозировках, примененных в первой исследуемой группе и в группе сравнения соответственно.
Возраст пациенток группы сравнения (37 женщин) составил 28,8±0,43 года. У всех к моменту начала исследования при гинекологическом осмотре отсутствовала патология шейки матки. Средний возраст наступления менархе – 13,3±0,2 года. Начало половой жизни – с 16,7±0,29 лет. На группу в среднем пришлось 2,5±0,07 беременностей, 0,9±0,01 родов, 1,3±0,07 абортов, 0,3±0,04 выкидышей. Из гинекологических заболеваний при клиническом обследовании на группу сравнения до начала исследования приходились 21 эндоцервицит, восемь кольпитов, четыре аднексита, и у четырех пациенток не было выявлено другой гинекологической патологии, кроме ВПГ. По данным УЗИ, у двух пациенток выявлен аднексит, у пяти – эндометриоз и у 29 женщин из этой группы не было определяемой на УЗИ патологии. Онкоцитология выявила в группе картину воспаления в 12 случаях, дисплазию в восьми случаях и отсутствие патологии в 17 случаях. По данным кольпоскопии, к началу исследования у 14 больных выявлены признаки воспаления и у 23 женщин отмечалась благоприятная кольпоскопическая картина.
Возраст пациенток первой исследуемой группы (32 женщины) составил 27±0,36 лет. При гинекологическом осмотре к началу исследования патология шейки матки у всех отсутствовала. Средний возраст наступления менархе – 13,2±0,08 года; половой дебют – в 17,5±0,22 года. На группу в среднем пришлось 2,4±0,11 беременностей, 0,8±0,33 родов, 1,4±0,08 абортов, 0,2±0,04 выкидышей. Из гинекологических заболеваний при клиническом обследовании на группу сравнения до начала исследования приходились 12 эндоцервицитов, один случай эндометриоза, и у 19 пациенток не было выявлено другой гинекологической патологии, кроме ВПГ. По данным УЗИ, у четырех пациенток выявлен аднексит, у четырех – эндометриоз и у 24 женщин из этой группы не было определяемой на УЗИ патологии. Онкоцитология выявила в группе картину воспаления в девяти случаях, дисплазию – в шести случаях и отсутствие патологии – в 17 случаях. По данным кольпоскопии, к началу исследования у 16 пациенток выявлены признаки воспаления и у 16 женщин отмечалась благоприятная кольпоскопичесая картина.
Возраст пациенток второй исследуемой группы (32 женщины) составил 27,8±0,33 года. При гинекологическом осмотре к началу исследования патология шейки матки у всех отсутствовала. Средний возраст наступления менархе – 13,1±0,1 года: начало половой жизни – в 16,2±0,34 года. На группу в среднем пришлось 2,3±0,07 беременностей, 0,9±0,03 родов, 1,1±0,03 абортов, 0,3±0,05 выкидышей. Из гинекологических заболеваний при клиническом обследовании на группу сравнения до начала исследования приходились 19 эндоцервицитов, один кольпит, четыре аднексита и у восьми пациенток не было выявлено другой гинекологической патологии, кроме ВПГ. По данным УЗИ, у четырех пациенток выявлен аднексит, у трех – эндометриоз и у 25 женщин из этой группы не было определяемой на УЗИ патологии. Онкоцитология выявила в группе картину воспаления в 11 случаях, дисплазию – в шести случаях, и отсутствие патологии – в 15 случаях. По данным кольпоскопии, к началу исследования у 13 пациенток выявлены признаки воспаления и у 19 женщин отмечалась благоприятная кольпоскопичесая картина.
Во всех трех группах наблюдалась сходная картина инфицирования пациенток ВПГ-1 или ВПГ-2 перед началом лечения.
Была выявлена статистическая достоверность между группами по описанным клиническим параметрам. Уровень достоверности р≤0,01-0,05.
В группе сравнения (см. рис. 1) обращает на себя внимание прогредиентное снижение эффекта от стандартной терапии валацикловиром в течение года. Через 9 мес. в группе сравнения серонегативных пациенток уже не было. У всех показатели типоспецифических IgG вернулись к значениям «до лечения».
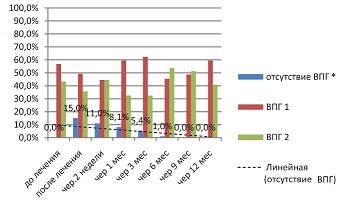 | Рисунок 1: Инфицированность ВПГ в группе сравнения (валацикловир), по данным ИФА (индекс позитивности IgG у всех больных перед началом лечения в среднем >1,1).
Примечание. P≤0,05. |
В первой исследуемой группе (см. рис. 2) виден отчетливый тренд на увеличение количества серонегативных пациенток в результате применения Ферровира, раствор 15 мг/мл.
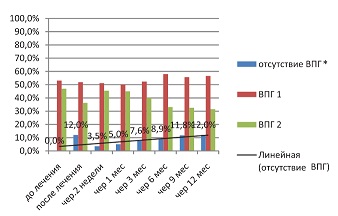 | Рисунок 2: Инфицированность ВПГ в первой исследуемой группе (Ферровир®, 15 мг/мл), по данным ИФА (индекс позитивности IgG у всех больных перед началом лечения в среднем >1,1).
Примечание. P≤0,05. |
Во второй исследуемой группе (см. рис. 3) тренд на сохранение противовирусного эффекта валацикловира на фоне применения противовирусного препарата с иммуномодулирующим эффектом Ферровир® (15 мг/мл) еще более очевиден.
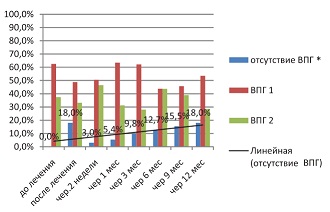 | Рисунок 3: Инфицированность ВПГ во второй исследуемой группе (Ферровир, 15 мг/мл+валацикловир), по данным ИФА (индекс позитивности IgG у всех больных перед началом лечения в среднем >1,1).
Примечание. P≤0,05. |
В группе сравнения (см. рис. 4), где проводилась стандартная, официально рекомендованная терапия валацикловиром, не отмечается увеличения количества высокоавидных IgG. Это хорошо согласуется с механизмом противовирусного действия валацикловира, не связанным с воздействием на В-лимфоциты.
В этой группе обращает на себя внимание прогредиентное снижение эффекта от стандартной терапии валацикловиром в течение года. Через 9 мес. в группе сравнения серонегативных пациенток уже не было. У всех показатели типоспецифических IgG вернулись к значениям «до лечения».
В первой исследуемой группе виден отчетливый тренд на увеличение количества серонегативных пациенток в результате применения препарата Ферровир®, 15 мг/мл.
Во второй исследуемой группе тренд на сохранение противовирусного эффекта валацикловира на фоне применения иммуномодулятора Ферровир® еще более очевиден.
В группе сравнения, где проводилась стандартная, официально рекомендованная терапия валацикловиром, не отмечается увеличения количества высокоавидных IgG. Это хорошо согласуется с механизмом противовирусного действия валацикловира, не связанным с воздействием на В-лимфоциты.
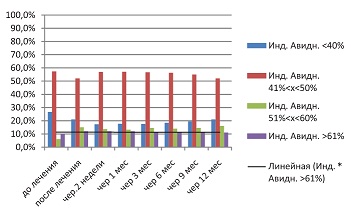 | Рисунок 4: Изменение индекса авидности IgG в группе сравнения (валацикловир).
Примечание. P≤0,01. |
Вирусная нагрузка в группе сравнения (валацикловир) (см. рис. 5) снижается в течение первого месяца лечения, что объясняется быстрым вируцидным и вирустатическим действием валацикловира. Также закономерно она повышается в течение всего оставшегося периода мнаблюдения, так как валацикловир не обладает кумулятивным фармакологическим эффектом и стимулирующим влиянием на иммунную систему организма. Повышение уровня вирусной нагрузки, по данным ПЦР, объясняется сниженной иммунной компетентностью ВПГ-инфицированных субъектов или активизацией латентно персистирующего вируса под влиянием неблагоприятных внешних воздействий на организм.
 | Рисунок 5: Вирусная нагрузка в группе сравнения (валацикловир), по данным ПЦР.
Примечание. P≤0,05. |
В первой исследуемой группе, где проводилась монотерапия препаратом Ферровир®, 15 мг/мл (см. рис. 6), виден отчетливый тренд повышения индекса авидности типоспецифических IgG. Это хорошо объяснимо иммуномодулирующим механизмом противовирусного действия Ферровира. Он включает в себя стимуляцию TLR 9 B-лимфоцитов (центробластов). В последних происходит активный процесс соматической гипермутации, приводящий к формированию разнообразия антител и повышению их авидности.
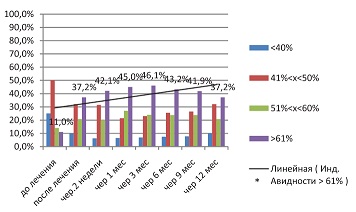 | Рисунок 6: Изменение индекса авидности IgG в первой исследуемой группе (Ферровир®, 15 мг/мл).
Примечание. P≤0,01. |
Вирусная нагрузка у пациенток первой исследуемой группы на фоне терапии препаратом Ферровир®, 15 мг/мл (см. рис. 7), снижается постепенно и достигает наименьших значений к третьему месяцу лечения. Это можно объяснить иммуномодулирующим характером противовирусного действия Ферровира, требующего определенного времени на антигензависимую позитивную селекцию В-лимфоцитов, их трансформацию в плазматические клетки, и синтез последними достаточного количества типоспецифических IgG. Но, с другой стороны, создание клона плазматических клеток, синтезирующих высокоавидные, типоспецифические IgG, обеспечивает длительный контроль за очагами латентного персистирования ВПГ.
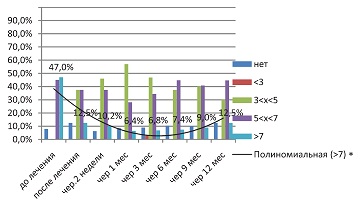 | Рисунок 7: Вирусная нагрузка в первой исследуемой группе (Ферровир®,15 мг/мл ), по данным ПЦР.
Примечание. P≤0,05. |
У женщин из второй исследуемой группы, получавших валацикловир и Ферровир®, 15 мг/мл (см. рис. 8), повышение титра высокоавидных, типоспецифических IgG несколько менее выражено, чем в первой группе. Это можно объяснить присутствием в схеме прегравидарной подготовки валацикловира, оказывающего вирустатическое действие, которое, в свою очередь, способствует уменьшению антигенного разнообразия ВПГ и, соответственно, снижению возможности антигензависимой позитивной селекции В-лимфоцитов в герментативных центрах лимфоузлов, обеспечивающей соматическую гипермутацию и повышение авидности антител.
 | Рисунок 8: Изменение индекса авидности IgG во второй исследуемой группе (валацикловир+Ферровир®, 15 мг/мл).
Примечание. P≤0,01. |
Динамика вирусной нагрузки во второй исследуемой группе (валацикловир + Ферровир®, 15 мг/мл) (см. рис. 9) была сходной с группой сравнения в части резкого ее падения в первый месяц лечения, что объясняется быстрым эффектом валацикловира. И, в то же время, кривая показателя вирусной нагрузки к концу периода наблюдения достигает низких значений, как в первой исследуемой группе, что обусловлено длительным иммуномодулирующим эффектом Ферровира, 15 мг/мл.
 | Рисунок 9: Вирусная нагрузка во второй исследуемой группе (валацикловир+Ферровир®, 15 мг/мл), по данным ПЦР.
Примечание. P≤0,05. |
В этой группе (см. рис. 10) тренд на снижение неспецифического воспаления минимален, что легко объяснимо специфическим, избирательно противовирусным механизмом действия валацикловира, не оказывающим влияния на эукариотическую вагинальную флору.
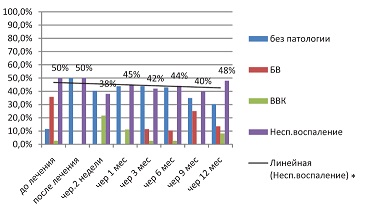 | Рисунок 10: Показатели мазка в группе сравнения (валацикловир) в период прегравидарной подготовки.
Примечание. P≤0,05. |
У женщин, получавших только терапию Ферровиром (см. рис. 11), виден отчетливый тренд на уменьшение неспецифического воспаления, что закономерно обусловлено иммуномодулирующим эффектом препарата.
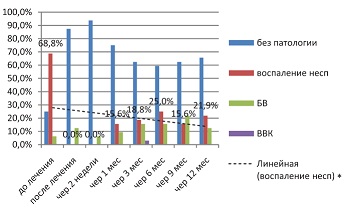 | Рисунок 11: Показатели мазка в первой исследуемой группе (Ферровир®, 15 мг/мл) в период прегравидарной подготовки.
Примечание. P≤0,05. |
Схожая тенденция снижения уровня неспецифического воспаления, обеспечиваемого Ферровиром, отмечается и во второй исследуемой группе (см.
рис. 12).
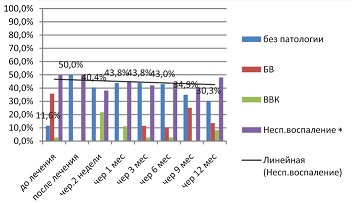 | Рисунок 12: Показатели мазка во второй исследуемой группе (валацикловир+Ферровир®, 15 мг/мл) в период прегравидарной подготовки.
Примечание. P≤0,05. |
Нами отмечена более высокая частота наступления беременности была в группах, где в прегравидарную подготовку был включен Ферровир®, раствор для внутримышечного введения 15 мг/мл: в группе Ферровир® – 28,1%, в группе алацикловир+Ферровир® – 31,3%, и в группе валацикловир – 13,5% соответственно (р≤0,05). Это, на наш взгляд, объясняется иммуномодулирующим эффектом препарата Ферровир®, уменьшающим проявления ВЗОМТ, и, соответственно, улучшающим качество мазка на патогенную и/или условно-патогенную флору.
Частота потери беременности от различных причин (выкидыши на ранних сроках, при недиагностированной беременности; выкидыши в срок до 8 нед., после 8 нед.), была достоверно ниже (P≤0,05) в группах прегравидарной подготовки, включавших в программу Ферровир®, раствор для внутримышечного введения 15 мг/мл: в группе Ферровир® – 5,6%, в группе валацикловир+Ферровир® – 7%, в группе валацикловир – 7,9%.
Мы объясняем это иммуномодулирующим эффектом препарата, уменьшающим проявления ВЗОМТ. Вероятно также, что существенную роль в сохранении беременности играет достаточный уровень материнских типоспецифических высокоавидных IgG в крови эмбриона с первых недель беременности.
Выводы
1. Использование в прегравидарной подготовке стандартной, официально рекомендуемой схемы лечения валацикловиром имеет явные недостатки, проявляющиеся в исключении из эпидемиологической ситуации «вирус – хозяин» иммунной системы организма пациента. Они, в частности, выражаются в принципиальной невозможности организма задействовать врожденный и приобретенный иммунный ответ на антигены ВПГ-2.
2. Эти недостатки хорошо компенсируется включением в схему прегравидарной подготовки противовирусного препарата иммуномодулирующего действия Ферровир®, раствор для внутримышечного введения 15 мг/мл.
3. Наблюдается отчетливое нарастание индекса авидности типоспецифических IgG против ВПГ-2 в группах пациенток, получавших Ферровир®, раствор 15 мг/мл.
4. Частота наступления беременности у пациенток в группах подготовки с использованием Ферровира достоверно выше, чем в группе монотерапии валацикловиром.
5. Частота синдрома потери плода у пациенток с высоким индексом авидности типоспецифических IgG, генерированным применением Ферровира, достоверно ниже, чем у женщин из группы сравнения с фиксированными показателями титра IgG и индекса авидности.
Литература:
1. Филатов О.Ю., Кашаева О.В., Бугримов Д.Ю., Климович А.А. Морфофизиологические принципы иммунологического действия ДНК эукариот. Российский иммунологический журнал. 2013; 7 (4): 385-390.
2. Халдин А.А., Баскакова Д.В. Эпидемиологические аспекты заболеваний, вызываемых вирусом простого герпеса (обзор литературы). Consilium Medicum. Дерматология. 2007; 1: 27-30.
3. Anzivino E., Fioriti D., Mischitelli M. et al. Herpes simplex virus infection in pregnancy and in neonate: status of art of epidemiology, diagnosis, therapy and prevention. Virology Journal. 2009; 6: 40.
4. Baker David A. Consequences of herpes simplex virus in pregnancy and their prevention. Current Opinion in Infectious Diseases. 2007; 20 (1): 73-76.
5. Boggess K.A., Watts D.H., Hobson A.C., Ashley R.L., Brown Z.A., Corey L. Herpes simplex virus type 2 detection by culture and polymerase chain reaction and relationship to genital symptoms and cervical antibody status during the third trimester of pregnancy. American journal of obstetrics and gynecology. 1997; 176 (2): 443-51.
6. Cone R.W., Hobson A.C., Brown Z., Ashley R., Berry S., Winter C., Corey L. Frequent detection of genital herpes simplex virus DNA by polymerase chain reaction among pregnant women. JAMA. 1994; 272 (10): 792-6.
7. David W. Kimberlin, Chin-Yu Lin, Richard F. Jacobs, Dwight A. Powell, Lisa M. Frenkel, William C. Gruber, Mobeen Rathore, John S. Bradley, Pamela S. Diaz, Mary Kumar, Ann M. Arvin, Kathleen Gutierrez, Mark Shelton, Leonard B. Weiner, John W. Sleasman, Teresa Murguı́a de Sierra, Seng-Jaw Soong, Jan Kiell, Fred D. Lakeman, Richard J. Whitley. Natural history of neonatal herpes simplex virus infections in the acyclovir era. National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group Pediatrics. 2001; 108 (2): 223-9.
8. Gianluca Straface, Alessia Selmin, Vincenzo Zanardo, Marco De Santis, Alfredo Ercoli, Giovanni Scambia. Herpes Simplex Virus Infection in Pregnancy. Infectious Diseases in Obstetrics and Gynecology. 2012; 11: 385697.
9. Gupta R., Warren T., Wald A. Review Genital herpes. Lancet. 2007 Dec 22; 370 (9605): 2127-37.
10. Langenberg A.G., Kory L., Ashley R.L., Leong W.P., Straus S.E. A prospective study of new infections with herpes simplex virus type 1 and type 2. Chiron HSV Vaccine Study Group. New England Journal of Med. 1999; 341 (19): 1432-8.
11. http://dommedika.com/phisiology/776.html Dommedika.
12. James S.H., Kimberlin D.W. Neonatal Herpes Simplex Virus Infection: Epidemiology and Treatment. Clin Perinatol. 2015 Mar; 42 (1): 47-59.
13. Nicholas J Moss, Cynthia C Harper, Katherine Ahrens, Katherine Scott, Susan Kao, Nancy Padian, Tina Raine, Jeffrey D Klausner. Predictors of incident hersimplex virus type 2 infections in young women at risk for unintended pregnancy in San Francisco. BMC Infectious Diseases. 2007; 7: 113.
14. Paz-Bailey G., Ramaswamy M., Hawkes S.J., Geretti A.M. Herpes simplex virus type 2: epidemiology and management options in developing countries. Sex Transm. Infect. 2007; 83: 16-22.
15. Ratnam S., Severini A., Zahariadis G. et al. The diagnosis of genital herpes – beyond culture: An evidence-based guide for the utilization of polymerase chain reaction and herpes simplex virus type-srecific serology. Canadian journal infectious diseases medical microbiology. 2007; 18 (4); 233-240.
16. Roberts C.M., Pfister J.R., Spear S.J. Increasing proportion of herpes simplex virus type 1 as a cause of genital herpes infection in college students. Sexually Transmitted Diseases. 2003 Oct; 30 (10): 797-800.
17. Serdar H Ural, Thomas Chih Cheng Peng. Genital Herpes in Pregnancy Medscape. CME & Education Updated. 2013 Jan 23.
18. Wald A. Huang M.L. Carrell D. Selke S. Corey L. Polymerase chain reaction for detection of herpes simplex virus (HSV) DNA on mucosal surfaces: comparison with HSV isolation in cell culture. The Journal of infectious diseases. 2003; 188 (9): 1345-51.
19. Wald A., Zeh J., Selke S., Warren T., Ryncarz A.J., Ashley R., Krieger J.N., Corey L. Reactivation of genital herpes simplex virus type 2 infection in asymptomatic seropositive persons. New England Jourmal of Med. 2000 23 March; 342 (12): 844-50.
References:
1. Filatov O.Yu., Kashaeva O.V., Bugrimov D.Yu., Klimovich A.A. Rossiiskii immunologicheskii zhurnal. 2013; 7 (4): 385-390.
2. Khaldin A.A., Baskakova D.V. Consilium Medicum. Dermatologiya. 2007; 1: 27-30.
3. Anzivino E., Fioriti D., Mischitelli M. et al. Herpes simplex virus infection in pregnancy and in neonate: status of art of epidemiology, diagnosis, therapy and prevention. Virology Journal. 2009; 6: 40.
4. Baker David A. Consequences of herpes simplex virus in pregnancy and their prevention. Current Opinion in Infectious Diseases. 2007; 20 (1): 73-76.
5. Boggess K.A., Watts D.H., Hobson A.C., Ashley R.L., Brown Z.A., Corey L. Herpes simplex virus type 2 detection by culture and polymerase chain reaction and relationship to genital symptoms and cervical antibody status during the third trimester of pregnancy. American journal of obstetrics and gynecology. 1997; 176 (2): 443-51.
6. Cone R.W., Hobson A.C., Brown Z., Ashley R., Berry S., Winter C., Corey L. Frequent detection of genital herpes simplex virus DNA by polymerase chain reaction among pregnant women. JAMA. 1994; 272 (10): 792-6.
7. David W. Kimberlin, Chin-Yu Lin, Richard F. Jacobs, Dwight A. Powell, Lisa M. Frenkel, William C. Gruber, Mobeen Rathore, John S. Bradley, Pamela S. Diaz, Mary Kumar, Ann M. Arvin, Kathleen Gutierrez, Mark Shelton, Leonard B. Weiner, John W. Sleasman, Teresa Murguı́a de Sierra, Seng-Jaw Soong, Jan Kiell, Fred D. Lakeman, Richard J. Whitley. Natural history of neonatal herpes simplex virus infections in the acyclovir era. National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group Pediatrics. 2001; 108 (2): 223-9.
8. Gianluca Straface, Alessia Selmin, Vincenzo Zanardo, Marco De Santis, Alfredo Ercoli, Giovanni Scambia. Herpes Simplex Virus Infection in Pregnancy. Infectious Diseases in Obstetrics and Gynecology. 2012; 11 : 385697.
9. Gupta R., Warren T., Wald A. Review Genital herpes. Lancet. 2007 Dec 22; 370 (9605): 2127-37.
10. Langenberg A.G., Kory L., Ashley R.L., Leong W.P., Straus S.E. A prospective study of new infections with herpes simplex virus type 1 and type 2. Chiron HSV Vaccine Study Group. New England Journal of Med. 1999; 341 (19): 1432-8.
11. http://dommedika.com/phisiology/776.html Dommedika.
12. James S.H., Kimberlin D.W. Neonatal Herpes Simplex Virus Infection: Epidemiology and Treatment. Clin Perinatol. 2015 Mar; 42 (1): 47-59.
13. Nicholas J Moss, Cynthia C Harper, Katherine Ahrens, Katherine Scott, Susan Kao, Nancy Padian, Tina Raine, Jeffrey D Klausner. Predictors of incident hersimplex virus type 2 infections in young women at risk for unintended pregnancy in San Francisco. BMC Infectious Diseases. 2007; 7: 113.
14. Paz-Bailey G., Ramaswamy M., Hawkes S.J., Geretti A.M. Herpes simplex virus type 2: epidemiology and management options in developing countries. Sex Transm. Infect. 2007; 83: 16-22.
15. Ratnam S., Severini A., Zahariadis G. et al. The diagnosis of genital herpes – beyond culture: An evidence-based guide for the utilization of polymerase chain reaction and herpes simplex virus type-srecific serology. Canadian journal infectious diseases medical microbiology. 2007; 18 (4); 233-240.
16. Roberts C.M., Pfister J.R., Spear S.J. Increasing proportion of herpes simplex virus type 1 as a cause of genital herpes infection in college students. Sexually Transmitted Diseases. 2003 Oct; 30 (10): 797-800.
17. Serdar H Ural, Thomas Chih Cheng Peng. Genital Herpes in Pregnancy Medscape. CME & Education Updated. 2013 Jan 23.
18. Wald A. Huang M.L. Carrell D. Selke S. Corey L. Polymerase chain reaction for detection of herpes simplex virus (HSV) DNA on mucosal surfaces: comparison with HSV isolation in cell culture. The Journal of infectious diseases. 2003; 188 (9): 1345-51.
19. Wald A., Zeh J., Selke S., Warren T., Ryncarz A.J., Ashley R., Krieger J.N., Corey L. Reactivation of genital herpes simplex virus type 2 infection in asymptomatic seropositive persons. New England Jourmal of Med. 2000 23 March; 342 (12): 844-50.
THE SIGNIFICANCE OF IMMUNOMODULATORY THERAPY IN PREGRAVIDAL PREPARATION OF THE PATIENTS WITH RECURRENT HSV TYPE 2
Minaev N.N., Bugrimov D.Ju., Klimovich A.A.
Voronezh State Medical Academy named after NN Burdenko Russian Ministry of Health
Summary
Herpes simplex virus type 1 (HSV-1) and 2 (HSV-2) – is a widespread viruses that can form a lifelong infection and persistence. Genital herpes in women of childbearing age is a serious risk of vertical transmission from mother to fetus. Primary HSV infection and the first episode of genital HSV infections are particularly high risk of infection of the fetus and newborn. The infection rarely occurs in the uterus. Most often the virus is transmitted during childbirth. The greatest risk of transmission to the fetus and the newborn in the case of primary maternal infection occurred during the second half of pregnancy. The risk of transmission from mother to fetus and newborn, can be reduced or the appointment of antiviral drugs, or in specific cases, caesarean section. The purpose of this paper is to propose a possible strategy to prevent transmission of the virus from an infected mother to the fetus.
Key words
Recurrent HSV-2, pregravid preparation, maternal antibodies, Toll-like receptors 9, Ferrovir®.
Received: 20.02.2015; in the revised form: 24.02.2015; accepted: 25.03.2015.
Conflict of interests
The authors declared that they do not have anything to disclosure regarding funding or conflict of interests with respect to this manuscript.
All authors contributed equally to this article.
For citation
Minaev N.N., Bugrimov D.Ju., Klimovich A.A. The significance of immunomodulatory therapy in pregravidal preparation of the patients with recurrent HSV type 2. Akusherstvo, ginekologiya i reproduktsiya / Obstetrics, gynecology and reproduction. 2015; 1: 19-31 (in Russian). |
|