ТРОМБОФИЛИЯ, ТРОМБОЗЫ И АНТИТРОМБОТИЧЕСКАЯ ТЕРАПИЯ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Воробьев А.В., Макацария А.Д. Дата публикации на сайте: 2014-08-14 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
В клинической лекции приводятся современные представления о патогенезе тромботических осложнений у онкологических больных. При этом также рассматривается риск ятрогенной тромбофилии в условиях лучевой, химио и гормональной терапии. Дается научное обоснование необходимости противотромботической профилактики низкомолекулярными гепаринами.
THROMBOPHILIA, THROMBOSIS AND ANTITHROMBOTIC THERAPY IN CANCER PATIENTS Vorobev A.V., Makatsaria A.D.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Abstract: the clinical lection describes current views about pathogenesis of thrombotic complications in cancer patients. At the same time the risk of iatrogenic thrombophilia under the conditions of radio-, chemotherapy and hormone replacement therapy is considered. Issues concerning scientific explanation of antithrombotic prophylaxis with LMWH are given.
Key words: pathogenesis of thrombotic complications, cancer patients, thrombosis prevention, hemostasis abnormalities, low molecular weight heparin, unfractionated heparin.
Ключевые слова: патогенез тромботических осложнений, онкологические больные, профилактика тромбозов, нарушения гемостаза, низкомолекулярный гепарин, нефракционированный гепарин.
ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава РФ, Москва
Несмотря на то, что тромбофилия представляет собой значительную проблему у пациентов со злокачественными новообразованиями, до последнего времени изучением претромботического (гиперкоагуляционного) состояния при раке в значительной степени пренебрегали или давали только феноменологический подход к проблеме. Отчасти это связано с традиционным подходом к лечению злокачественных опухолей, который заключается в том, что максимум внимания уделяется лечению основного заболевания (то есть хирургическому вмешательству) и борьбе с метастазами (то есть лучевой, химио- и гормонотерапии), но не процессом метастазирования. При этом борьба с осложнениями, в частности тромботическими, отходит на второй план, а профилактика этих осложнений чаще всего не проводится вообще. Таким образом, полностью упускается из виду взаимовлияние как опухолевой ткани на систему гемостаза, так и свертывающей системы на рост и распространение новообразования.
По современным представлениям, тромбозы вен и артерий, тромбоэмболии, хронический синдром диссеминированного или локального внутрисосудистого свертывания крови (ДВС-синдром) являются грозными осложнениями у онкологических больных [3,14,15]. Клинически венозный тромбоэмболизм и рак имеют два основных проявления: с одной стороны, тромбоз может быть единственным клиническим симптомом скрыто протекающего рака, с другой – у пациентов с выявленным раком на всех стадиях заболевания может развиться тромбоз. В настоящее время уже не вызывает сомнений то, что у больных онкологическими заболеваниями тромбозы и тромбоэмболии возникают значительно чаще, о чем свидетельствуют современные многоцентровые исследования [1,25].
Актуальность проблемы тромбогеморрагических осложнений у онкологических больных способствует поиску новых способов эффективной диагностики тромбофилических состояний и методов профилактики этих осложнений с целью снижения преждевременной смертности этих тяжелых больных. Несмотря на неуклонный рост интереса к исследованию системы гемостаза при различных физиологических и патологических состояниях, что обусловлено высокой частотой тромботических осложнений, остаются малоизученными проблемы изменения системы гемостаза при различных новообразованиях.
В клинической онкологии тромботические осложнения относятся к наиболее часто встречающимся паранеопластическим синдромам и проявляются артериальными и венозными тромботическими окклюзиями, мигрирующим тромбофлебитом, эмболией легочной артерии, небактериальным тромбоэндокардитом, парадоксальными кровотечениями, тромботической микроангиопатией [3,25].
Можно выделить три категории факторов риска развития тромбозов у больных злокачественными новообразованиями. Первую категорию такого рода факторов мы обозначаем как «специфические опухользависимые», вторую – как «общепатологические факторы риска», третью – как «терапия-зависимые» факторы риска.
Патогенез тромбофилии у онкологических пациентов включает факторы, связанные с ответом на опухоль (воспаление, острофазовая реакция, диспротеинемия, очаговые некрозы, гемодинамические нарушения), а также специфические факторы, обусловленные самими опухолевыми клетками и связанными c опухолью макрофагами, а именно: прокоагулянтная и фибринолитическая активность раковых клеток, их взаимодействие с тромбоцитами, мононуклеарными макрофагами и эндотелием, неоангиогенез, лечебные мероприятия (химиотерапия, гормонотерапия). Опухолевые клетки активируют коагуляционную систему или систему фибринолиза, создавая условия для дальнейшего своего распространения, стимуляции ангиогенеза, повышения сосудистой проницаемости, что, в свою очередь, способствует метастазированию [7,12,25].
Большое значение имеет сочетанное влияние генетических форм тромбофилии и циркуляции АФА. У онкологических больных чаще всего выявляются: мутация FV Leiden, гипергомоцистеинемия (MTHFR C677T), полиморфизм PAI-1 G4/G5, полиморфизм тромбоцитарных гликопротеинов, дефицит AT III [14]. На настоящий момент недостаточно данных как о частоте генетических форм тромбофилии у онкологических больных, так и клинических проявлениях при их наличии. Из наших наблюдений можно сделать вывод о том, что наличие генетической тромбофилии, особенно мутации MTHFR, может быть серьезным фактором, провоцирующим клинически выраженные тромботические осложнения, а особенно – скрытые тромбозы, которые выявляются как патологоанатомические находки в 3-4 раза чаще [2,3].
Наличие злокачественного новообразования само по себе является постоянным фактором риска редидивирующего тромбоза, при этом риск значительно возрастает при наличии других факторов: возраст более 60 лет, повышенный вес, тромботические осложнения в анамнезе. Различные режимы терапии, безусловно, оказывают влияние на частоту тромботических осложнений. Оперативное вмешательство и последующая иммобилизация, химиотерапия, лучевая терапия, постановка венозного катетера увеличивают риск развития тромботических осложнений [4,6,9,14,21].
Крайне важным в патогенезе тромбофилии при злокачественных новообразованиях является ятрогенное влияние гормональной терапии, а также химио- и лучевой терапии злокачественных новообразований. Применяемые агрессивные методы лечения опухолей оказывают разнообразное влияние на систему гемостаза. На сегодняшний момент нет никаких сомнений, что химио-, лучевая и гормональная терапия способствует поддержанию и усилению тромбофилического состояния и соответственно возникновению тромбогеморрагических осложнений [5,8,19,23]. Однако патогенез такого рода ятрогенной тромбофилии до конца не ясен, и это связано с тем, что в формирование тромбофилического состояния вовлечено значительное число факторов: начиная от хирургического этапа лечения и связанной с этим иммобилизации и заканчивая наличием венозного катетера, который устанавливают на длительный срок [4].
Активная химиотерапия – независимый фактор риска возникновения тромботических осложнений у онкологических пациентов. Лучевая терапия также увеличивает риск тромботических осложнений. Также для проведения полихимиотерапии как правило возникает необходимость катетеризации периферических или центральных вен. Было описано, что при постановке подключичного катетера тромботические осложнения выявляются в 0,3-14%, при постановке периферических катетеров – гораздо чаще – в 4,5-26% [23].
По нашим данным, при проведении химио- и лучевой терапии признаки тромбофилии и ДВС-синдрома обнаружены у 90% пациенток. Во время проведения курсов у 8% отмечено развитие тромбогеморрагических осложнений. Обнаружено, что у 19% пациенток с раком тела матки и шейки матки при проведении лучевой терапии концентрация комплексов ТАТ, Д-димера, F1+2 значительно выше нормальных значений и не имеет тенденции к спонтанной нормализации без специфической антикоагулянтной терапии (низкомолекулярный гепарин – надропарин). У 15,6% обнаружена коагулопатия потребления во время курсов лучевой терапии [1,3].
С одной стороны, механизмы запуска свертывания крови у пациентов, страдающих злокачественными новообразованиями, включают общие факторы, связанные с ответом хозяина на опухоль (воспаление, острофазовая реакция, диспротеинемия, очаговые некрозы, гемодинамические нарушения) и более определенные факторы типа действий, выраженных опухолевыми клетками и связанными опухолью макрофагами: прокоагулянтная, фибринолитическая активность раковой клетки, взаимодействие с тромбоцитами, мононуклеарными макрофагами, эндотелием, неоангиогенез, лечебные мероприятия (химиотерапия, гормонотерапия) [5,8,9,14].
С другой стороны, опухолевая клетка активирует коагуляционную систему или систему фибринолиза с целью дальнейшего распространения, обеспечения максимального ангиогенеза, повышения сосудистой проницаемости, что, в свою очередь, способствует метастазированию. Основная роль при этом принадлежит высвобождению прокоагулянтов и цитокинов из опухолевых клеток. Также отмечается повреждение эндотелия, уменьшение активности ингибиторов коагуляции и активаторов фибринолиза.
В основе патогенеза гемостазиологической паранеоплазии лежит активация как коагуляционного, так и сосудисто-тромбоцитарного звеньев свертывания крови, что обеспечивается [8,14]:
1) нарушением структурной целостности и функциональной стабильности сосудистого эндотелия опухолевыми клетками и цитокинами;
2) активацией тромбоцитов опухолевыми клетками, приводящей к их повышенной адгезии и агрегации;
3) синтезом прокоагулянтов и ингибиторов фибринолиза опухолевыми клетками;
4) прокоагулянтной активностью опухоль-ассоциированных макрофагов и активированных моноцитов периферической крови.
Общепатологический смысл нарушений в системе гемостаза, чаще по типу развития ДВС-синдрома из-за избыточной активации систем коагуляции, антикоагуляции и фибринолиза со стороны организма, состоит в ограничении распространения опухоли, а со стороны опухоли – в увеличении метастатического потенциала и создании условий для максимально быстрого роста.
С точки зрения биологии опухоли, местные явления в пределах опухоли и на ее поверхности, а также внешних кровеносных сосудах, имеют главное значение. Формирование фибрина вызвано TF, который активирует коагуляционный каскад, активируя фактор X, преобразование протромбина в тромбин и затем фибриногена в фибрин и стабилизацию фибрина. Фибрин – механическая поддержка для опухоли, способствует ее росту. Осаждение фибрина на поверхности опухоли является барьером для иммунной системы. Образование фибрина является результатом активации свертывания крови, которая сопровождает такие процессы, как тромбоз, рост опухоли, воспаление и играет при этом существенную роль в патологическом ответе тканей. Вслед за повреждением тканей происходит экстравазация фибриногена из кровеносных сосудов в экстраваскулярное пространство с образованием фибринового матрикса. Воспалительные клетки и эндотелиальные клетки мигрируют в такой матрикс и стимулируют процессы репарации. Во-вторых, через какое-то время гель фибрина преобразовывается в зрелую васкуляризированную соединительную ткань путем активации ангиогенеза. В-третьих, фибрин имеет существенное влияние на воспалительную инфильтрацию опухоли, заключающееся в регулировании формирования стромы и защиты опухоли от иммунной системы [5,9,14].
И гемостаззависимые и независимые механизмы вызывают ангиогенез. Тканевой фактор (TF) индуцирует гемостазнезависимый механизм через фосфорилирование эндоплазматического хвоста и последующих каскадов трансдукции сигнала. TF индуцирует ангиогенез через гемостаззависимый механизм, генерируя тромбин. Тромбин также стимулирует ангиогенез через гемостазнезависимые и зависимые механизмы. Гемостазнезависимые механизмы опосредуются путем расщепления рецепторов активированных протеаз (PARs) и последующей активации каскада трансдукции сигнала, связанной с протеином G, которые стимулируют связанные с ангиогенезом гены. Гемостаззависимые механизмы опосредуются через осаждение фибрина и активацию тромбоцитов [14].
Действие сосудистого эндотелиального фактора роста (VEGF) и фактора некроза опухоли (TNF-a) также регулирует прокоагулянтную активность TF, что ведет к развитию системной гиперкоагуляции, свойственной многим раковым пациентам.
Таким образом, принципиально важным является тот факт, что активация системы гемостаза – не просто сопутствующий злокачественному новообразованию процесс, как, например, сдавление окружающих органов опухолевыми массами, обусловливающее ишемию этих органов или интоксикацию организма при развитии опухолевого процесса, оно имеет глубокий общепатологический смысл. Активируя систему гемостаза и являясь причиной развития ДВС-синдрома, для опухолевой ткани создаются условия для роста из-за опухолевого ангиогенеза и распространения за счет метастазирования раковых клеток. Таким образом, контроль за состоянием системы гемостаза и меры, направленные на профилактику тромбофилии, являются не профилактикой тромбогеморрагических осложнений у онкологических больных, а лечением основного заболевания за счет блокирования путей роста (ангиогенеза) и метастазирования опухоли [3,14].
Большинство общеоценочных коагуляционных тестов малоинформативны при хронических или компенсированных формах ДВС-синдрома. Наиболее целесообразна оценка уровня следующих маркеров: повышение уровней F1+2 и FPA прямо свидетельствует о повышении прокоагулянтной активности; снижение уровня AT III косвенно свидетельствует о прокоагулянтной активности и потреблении ингибиторов; повышение уровня ТАТ прямо свидетельствует о повышении прокоагулянтной активности и потреблении ингибиторов. Фактор 4 тромбоцитов (PF4) и β-тромбоглобулин β-TG являются молекулярными маркерами общей реактивности тромбоцитов и реакции высвобождения, они обычно повышены у больных с ДВС. Эти же тесты являются и хорошими маркерами эффективности проводимой терапии при ДВС. Однако, помимо преимуществ, тесты PF4 и β-TG имеют и недостатки и связаны они, в первую очередь, с нестандартностью их в отношении ДВС: оба показателя могут быть повышены при целом ряде других состояний (ТЭЛА, инфаркт миокарда, искусственные клапаны сердца, аутоиммунные заболевания, тромбоз глубоких вен и пр.). Следует, однако, учитывать также и то, что повы-шение уровней PF4 и β-TG может быть косвенным свидетельством прокоагулянтной активности [1,14].
Вопросы профилактического применения средств антиагрегантов и антикоагулянтов в практической онкологии решаются неоднозначно. Так, достаточным обоснованием для применения антиагрегантов является выявление гиперактивности тромбоцитов даже без выраженных при-знаков активации тромбиногенеза, что вполне соответствует профилактической роли антиагрегантов в подавлении начальных этапов внутрисосудистого свертывания крови, при которых тромбоцитарные реакции являются ведущими инициальными нарушениями [1,2].
Наиболее перспективным средством профилактики тромбофилии и тромбозов у онкологических больных является низкомолекулярный гепарин (НМГ), что связано с рядом его особенностей [18,22]:
– 30% активности НМГ осуществляется через AT III и 70% через TFPI;
– активирует фибринолиз путем освобождения из эндотелия t-РА;
– ингибирует прокоагулянтное действие лейкоцитов;
– НМГ меньше подвержены действию антигепаринового фактора 4 тромбоцитов (PF4), соответственно реже вызывают гепариновую иммунную тромбоцитопению;
– эффективен при резистентности к варфарину;
– не нуждается в постоянном лабораторном контроле;
– вероятнее всего, обладает прямым противоопухолевым и антиангиогенным эффектом.
Кроме антикоагулянтных эффектов НМГ, перспективно изучение и неантикоагулянтных его эффектов, особенно значимое у онкологических больных: обладает иммуномодулирующим действием, противовоспалительным эффектом; ингибирует экспрессию онкогенов; ингибирует пролиферацию эндотелиальных клеток; индуцирует апоптоз опухолевых клеток; вызывает системное высвобождение b-FGF, гепацитарного фактора роста и фактора некроза опухоли; вызывает повышение реактивности лимфоцитов и усиленние их агрегации, стимуляцию клеточной активности естественных киллеров; препятствует экспрессии TF эндотелием под действием противовоспалительных цитокинов; снижает адгезию раковых клеток к эндотелию, а соответственно ангиогенез и метастазирование; предотвращает взаимодействие тромбоцит – раковая клетка за счет связывания тромбоцитов Р-селектином и, следовательно, метастазирование [18].
Важно провести разграничение между целями терапевтического назначения гепарина. В тех случаях, когда гепарин используется для профилактических целей, образование тромбина ограничивается выраженным повышением активности AT III под действием гепарина. Применение малых (профилактических) доз гепарина, то есть доз, не превышающих 15 000 ЕД в сут., преследует цель нейтрализовать образующийся в избыточных количествах активированный фактор X, чтобы предупредить образование тромбина, вызывающего выраженную гиперкоагуляцию. Показанием для применения малых доз гепарина являются состояния, когда следует ожидать повышенного образования тромбина [1,3].
Несмотря на множество плюсов применения обычного, нефракционированного, или, иначе, высокомолекулярного гепарина, он обладает рядом нежелательных побочных эффектов, которые в основном предопределены его структурой. Вследствие гетерогенности структуры НГ имеет низкую биодоступность (30%), так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор 4), образуя комплекс «гепарин – фактор 4», что чревато возникновением гепариновой иммунной тромбоцитопении вследствие образования антител к этому комплексу. Такая тромбоцитопения часто осложняется тромбозами. Одним из нежелательных эффектов гепарина является также его способность уменьшать уровень AT III при использовании больших доз, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина в такой ситуации не приводит к антикоагулянтному эффекту.
Следует отметить, что независимо от патогенетического механизма тромбозов, общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина различными путями. Если же учесть меньшую зависимость противотромботического эффекта НМГ от уровня AT III, чем у НГ, то можно думать о более успешном применении НМГ у больных с дефицитом AT III.
Важнейшим преимуществом НМГ по сравнению с НГ является, безусловно, более предсказуемый антикоагулянтный эффект, что связано с большей биодоступностью. НМГ в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не вызывают гепарин-индуцированные тромбозы [18,22].
Применение гепаринов в онкологической практике важно не только для профилактики тромбозов и эмболии. К положительным эффектам гепарина, кроме антикоагулянтного действия, следует отнести его способность ингибировать ростовые факторы, тормозить пролиферацию гладкомышечных клеток, рост и метастазирование опухолевых клеток. Ингибируя медиаторы воспаления (гистамин, серотонин, калликреин), гепарин оказывает противовоспалительное действие, а активируя липопротеиновую липазу – антиатерогенное действие за счет снижения содержания в крови липопротеидов низкой плотности. Cовременная онкология оснащена тремя видами лечения: 1) хирургическим; 2) лучевым; 3) лекарственным (химиотерапия, гормонотерапия, иммунотерапия). В настоящее время абсолютное большинство авторов полагают, что «исходя из значимости ряда факторов системы гемостаза в наборе биомассы опухоли при ее росте, в патогенезе метастазирования, высокой частоты тромбоэмболии у онкологических больных и данных о том, что тромбоз является второй причиной их смерти, установлено, что лекарственная коррекция системы гемостаза – это четвертый вид лечения онкологических больных» [19,21].
До сегодняшнего момента остается открытым вопрос о сроках и продолжительности антикоагулянтной терапии гепаринами (как НФГ и НМГ). В мировой литературе можно встретить мнение авторов, высказывающих опасение, что при активации противосвертывающей системы гепаринами накануне операции, хоть и создаются неблагоприятные условия для роста новообразований и формирования метастазов из отделившихся раковых клеток, однако устанав-ливается благоприятная ситуация для их активной диссеминации. Предложено на первом дооперационном этапе нормализовать функциональное состояние системы гемостаза, без активации ее противосвертывающего звена. После радикального удаления опухоли, когда нет опасности диссеминации раковых клеток, предлагается проводить антикоагулянтную терапию и активация антисвертывающих факторов будет способствовать усилению противоопухолевой ус-тойчивости организма. Но большинство авторов считают более целесообразным именно предоперационное профилактическое применение гепаринов у онкологических больных с умеренным и высоким риском тромбогеморрагических осложнений, так как в условиях активации противосвертывающей системы адгезия циркулирующих раковых клеток снижена, в то время как дополнительная активация свертывающей системы в условиях оперативного вмешательства обусловлена следующими факторами:
1) травмой (нарушением целостности тканей и сосудов);
2) наркозом;
3) иммобилизацией в состоянии миорелаксации.
Большое значение имеет также влияние гепарина на межклеточные взаимодействия, в частности, гепарин блокирует экспрессию Р-селектинов на поверхности тромбоцитов, а также затрудняет их связь со специфическими лигандами, что в значительной степени затрудняет процесс взаимодействия последних с раковой клеткой [9].
Имеется несколько механизмов, через которые гепарин может влиять на процесс ангиогенеза. Во-первых, антиангиогенный эффект гепарина зависит от его способности ингибировать лимфоцитарную гепараназу – фермент, обусловливающий инвазию опухолевой клетки и процесс метастазирования, внеклеточную супероксиддисмутазу и сиалидазу клеточной поверхности. Кроме того, другие полианион-связывающие ферменты типа обратной транскриптазы и терминальной деоксинуклеотид трансферразы ингибируются гепарином in vitro. Во-вторых, свободный гепарин может или увеличивать, или уменьшать пролиферацию эндотелиальных клеток. В зависимости от условий эксперимента большинство данных указывает на то, что действие происходит через мобилизацию и стабилизизацию ангиогенных факторов роста, находящихся во внеклеточном матриксе.
Имеются два ключевых фермента, а именно тромбин и u-РА, которые играют решающую роль в усилении прогрессии многих опухолей у животных и человека. Тот факт, что гепарин может оказывать влияние на опухолевые клетки, ингибируя тромбин или u-РА, подтверждено несколькими исследованиями. Гепарин усиливает инактивацию тромбина через PAI-1, НС-II, PCI и антитромбин и способствует антикоагулянтной активности активированным протеином С. Гепарин оказывает комплексное влияние на u-РА. Он перемещает u-РА с поверхности клетки в культуральную среду in vitro, увеличивая экспрессию гена u-РА в эндотелиальной клетке, и взаи-модействует с каталитической областью u-РА, чтобы увеличить активацию плазминогена [9,18,22].
По мнению ряда исследователей, антиметастатические свойства гепарина связаны с его способностью вызывать повышение реактивности лимфоцитов и усиленную их агрегацию, а также стимуляцию клеточной активности естественных киллеров в моделях опухоли мышей. Однако другие авторы считают, что в присутствии гепарина происходит ингибиция активации лимфоцитов и подавление активности естественных киллеров (NK-клеток). Результат введения гепарина в терапевтических дозах на функции иммунитета у человека изучены недостаточно.
Таким образом, противоопухолевый эффект гепарина связан не только с действием на систему гемостаза но и многочисленными неантикоагулянтными свойствами, в частности [3,14,18,22]:
– иммуномодулирующее действие гепарина;
– блокада адгезии опухолевых клеток к эндотелию, тромбоцитам, лейкоцитам за счет ингибирования экспрессии поверхностных P- и L-се-лективнов;
– ингибирование опухолевого неоангиогенеза;
– ингибирование пролиферации эндотелиальных клеток;
– индукция апоптоза;
– ингибирование гепараназы опухолевых клеток;
– взаимодействие с гликозамингликанами опухолевых клеток.
На рисунке 1 представлено патогенетическое обоснование применения НМГ у онкологических больных в модификации триады Вирхова [14].
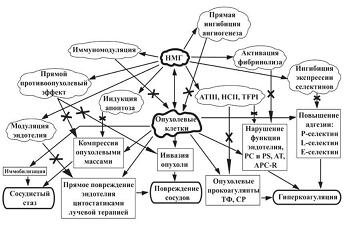 | Рисунок 1: Патогенетическое обоснование применения НМГ у онкологических больных в модификации триады Вирхова. |
Наиболее точными методами контроля гепаринотерапии являются определение активированного частичного тромбопластинового времени (АЧТВ) и определение активированного времени рекальцификации (АВР). Их использование имеет надежное тео-ретическое обоснование, потому что комплекс антитромбина III с гепарином инактивирует факторы свертывания XIIa, XIa, Xa, IXa, VIIIa, IIa (тромбин), уменьшение активности которых удлиняет показатели АЧТВ и АВР. Гепаринотерапия считается адекватной при увеличении показателей АЧТВ и АВР в 1,5-2,5 раза по сравнению с нормальными значениями [1].
Контроль терапии с помощью АЧТВ представляется наиболее воспроизводимым тестом в связи со стандартизацией активации факторов контакта и содержания фосфолипидов. Кроме того, учитывая его диагностическую значимость как показателя, характеризующего суммарную активность абсолютного большинства плазменных факторов крови, использование его в качестве метода контроля гепаринотерапии обеспечивает биологическую преемственность и последовательность интерпретации результатов.
Помимо биологических методов контроля гепаринотерапии в клинической практике используется прямое определение концентрации гепарина в крови. Доза гепарина считается адекватной при гепаринемии равной 0,2-0,5 ЕД/мл.
При этом профилактические дозы НМГ обычно не превышают 3400 анти-Ха ME и вводятся подкожно один раз в сутки. Длительность профилактики в разных клинических ситуациях различная, и прежде всего зависит от причины и степени риска тромбоза. В настоящее время ведутся интенсивные исследования, посвященные разработке оптимальных режимов профилактики НМГ при различных клинических состояниях. Большим преимуществом профилактики НМГ является также то, что пациенты самостоятельно могут осуществить ее дома, поскольку в отличие от НГ, нет необходимости контроля дозы.
У онкологических больных эффективна длительная (не менее 1-3 мес.) профилактика ТГВ низкомолекулярным гепарином, поскольку тромбофилическое состояние после хирургического вмешательства у них сохраняется дольше, что связано не только с выбросом большого количества тромбопластических субстанций в кровь во время операции, но и характером основного заболевания. В настоящее время интенсивно исследуются возможности постоянной антикоагуля-ции у пациентов со злокачественными опухолями. Поскольку профилактика НМГ подразумевает определенный временной отрезок, речь идет о возможности в дальнейшем перманентной пожизненной антикоагуляции варфарином в так называемых мини-дозах (менее 2,5 мг). В случаях среднего и низкого риска ТГВ НМГ назначаются, по крайней мере, в течение 10 дней после операции. Таким образом, НМГ эффективно снижают частоту послеоперационных тромбозов (почти на 70%) и не повышают риск серьезных геморрагических осложнений при преоперативном назначении. В случаях, когда НМГ назначаются в послеоперационном периоде, они не повышают риск геморрагии [3].
На сегодняшний день существует множество НМГ, производимых разными странами и различными методами, что обуславливает и некоторые отличия в биологической активности этих препаратов (см. табл. 1). При подборе терапии следует учитывать, что различные препараты НМГ обладают различными свойствами, что может отразиться на их клинической эффективности. Таким образом, результаты, полученные в исследованиях с использованием одного препарата НМГ, нельзя переносить на другие препараты данной группы. При выборе препарата и режимов его применения необходимо руководствоваться данными об эффективности и безопасности каждого конкретного препарата для каждого показания в отдельности.
Таблица 1. Сравнительная характеристика препаратов низкомолекулярного гепарина.
| Препарат | Средняя молекулярная масса, Да | Отношение анти-Ха-активности/и антитромбиновой активности | Метод получения |
|---|
| Надропарин кальция | 4300 | 3,6 | Дезаминирование азотной кислотой | | Эноксапарин натрия | 4500 | 3,8 | Расщепление с β-элиминированием щелочью | | Далтепарин натрия | 6000 | 2,7 | Дезаминирование азотной кислотой | | Ревипарин натрия | 3900 | 3,5 | Дезаминирование азотной кислотой | | Тинзапарин натрия | 4500 | 1,9 | Расщепление с β-элиминированием гепариназой |
Длительное время при необходимости продолжительной профилактики тромбоэмболических осложнений (при химиотерапии, после перенесенного тромбоза) применялся варфарин. Однако его использование сопряжено с рядом трудностей: узкой терапевтической широтой и необходимостью постоянного контроля показателей свертывающей системы. По данным рандомизированного исследования Pini и соавт. (1994), варфарин и НМГ обладают примерно одинаковой эффективностью для вторичной профилактики тромботических осложнений у онкологических больных, однако использование НМГ сопряжено с меньшим риском геморрагических осложнений [4,25].
Согласно всем современным рекомендациям и гайд-лайнам в периоперативном периоде профилактика НМГ и даже НФГ показана всем онкологическим больным, при этом рекомендуемая доза НМГ – 3400 анти-Ха ME, НФГ – 5000 МЕ 3 раза в сутки, продолжительность профилактики не менее месяца после оперативного вмешательства [1,3,4,13,25]. У пациентов с тромботическими осложнениями рекомендована более длительная профилактика: для продолжения профилактики рекомендуется назначение варфарина под контролем МНО в течение 3-6 мес. Однако большинство исследователей считает, что применение НМГ в течение 3-6 мес. в дозе 60-75% от первоначальной более эффективно, чем назначение варфарина [6,10,12].
При профилактическом применении целевой уровень анти-Ха-активности составляет 0,1-0,5 МЕ/мл; при применении более высоких доз в лечебных целях – 0,6-1,0 МЕ/мл (при применении один раз в день) или 1,0-2,0 МЕ/мл (при применении 2 раза в день). Анти-Ха активность определяется через 4 часа после инъекции НМГ.
Минимальная доза гепарина – 5000 ЕД подкожно 2 раза в сут., средняя доза – 5000 ЕД 3 раза в сут. При этом целевой уровень АЧТВ должен составлять 1,5-2,5 и соответствовать уровню анти-Ха-активности 0,35-0,7 ЕД/мл [4]. Дозы НМГ, используемые для профилактики и лечения тромбоэмболических осложнений, указаны в таблице 2.
Таблица 2. Дозы низкомолекулярного гепарина (НМГ), используемые для профилактики и лечения тромбоэмболических осложнений (ВТЭ – венозные тромбозы и эмболии).
| Препарат НМГ | Профилактика ВТЭ | Лечение ВТЭ |
|---|
| Средний риск | Высокий риск |
|---|
| Эноксапарин | 40 мг 1 раз в сут. | 40 мг 2 раза в сут. | 1 мг/кг 2 раза в сут. или 1,5 мг/кг 1 раз в сут. | | Далтепарин | 5 000 ЕД 1 раз в сут. | 5 000 ЕД 2 раза в сут. | 200 ЕД/кг 1 раз в сутки или 100 ЕД/кг 2 раза в сут. (максимум 180 мг в сут.) | | Надропарин | 0,3 мл 1 раз в сут. | 40-60 ЕД/кг в сут. | 200 ЕД/кг в сут.
При весе менее 50 кг – 4100 ЕД; 50-70 кг – 6150 ЕД, более 70 кг – 9200 ЕД 2 раза в сут. (максимум 17 000 ЕД в сут.) | | Тинзапарин | 3500 ЕД в сут. | 50-75 ЕД/кг в сут. | 175 ЕД/кг 1 раз в сут. (максимум 18 000 ЕД в сут.) | | Ревипарин | 1750 ЕД в сут. | 4200 ЕД 2 раза в сут. | 45-69 кг – 4200 ЕД
Более 60 кг – 6300 ЕД 2 раза в сут. |
Однако в большинстве руководств не рекомендуется проведение рутинной профилактики у онкологических больных, проходящих курсы адъювантной или послеоперационной химиотерапии амбулаторно.
Также дискутабельным является вопрос профилактического применения гепаринов у пациентов с дли-тельно установленными венозными катетерами как периферическими, так и центральными.
Кроме того, несмотря на ряд пилотных исследований, показавших, что применение гепарина увеличивает продолжительность жизни у онкологических больных, на настоящий момент нет оснований для длительного применения их у пациентов без тромботических осложнений в анамнезе. При этом следует отметить два важных обстоятельства:
1. Противотромботические препараты и в первую очередь НМГ у онкологических пациентов не только показаны как профилактика тромбогеморрагических осложнений, но и как патогенетически обусловленная профилактика роста опухоли и метастазирования.
2. Назначение антикоагулянтной терапии показано:
а) на всех стадиях распространения опухли;
б) должно сопровождать и хирургическое лечение, и последующие курсы химио-, лучевой и гормональной терапии.
Не следует забывать, что одним из достоинств терапии НМГ у онкологических пациентов является профилактика ятрогенных тромбогеморрагических осложнений.
При периоперативной профилактике НМГ следует учитывать следующие составляющие повышенного риска интра- и послеоперационных геморрагических осложнений: препарат, операция, пациент. Характеристики препарата включают вид НМГ, дозу, антикоагулянтный ответ, время назначения и метод введения. Важное значение имеют тип хирургической операции, ее травматичность и длительность.
Со стороны пациента играют важную роль такие факторы как возраст, применение нестероидных противовоспалительных препаратов незадолго до операции или других препаратов, потенцирующих эффект НМГ, и наличие злокачественной опухоли.
На основании вышеизложенного можно заключить, что низкомолекулярный гепарин является препаратом выбора не только для лечения и тромботических осложнений и профилактики тромбофилических состояний у онкологических больных, но и профилактическим средством опухолевого роста и метастазирования. При этом НМГ просты в применении, не требуют постоянного лабораторного контроля, более безопасны по сравнению с препаратами других групп.
Мы считаем оправданным назначение специфической профилактики тромботических осложнений не только в периоперативном периоде, и при проведении курсов химио- и лучевой терапии. Поскольку действие низкомолекулярного гепарина не ограничивается профилактикой тромбо-геморрагических осложнений, а направлено на профилактику тромбофилии в целом, то можно ставить вопрос о профилактическом назначении НМГ с момента обнаружения новообразования как профилактики роста и метастазирования опухоли. Однако на данный момент пока что не проведено исследований, могущих подтвердить данные рекомендации. В большинстве зарубежных гайд-лайнов вопрос применения НМГ во время амбулаторного периода лечения онкологических пациентов до сих пор не определен. Однако мы считаем, что при проведении периодического лабораторного контроля назначение НМГ у таких пациентов позволит значительно улучшить течение основного заболевания. Таким образом, следует более широко рассматривать показания к назначению НМГ у онкологических больных: перманентная терапия НМГ показана всем онкологическим пациентам на всех этапах течения заболевания, и только при наличии высокого риска развития геморрагических осложнений терапия НМГ может быть временно прекращена.
Безусловно, любая терапия, особенно антикоагулянтная, требует учета конкретной клинической ситуации и обязательного учета возможных противопоказаний. Важно помнить изречение одного из ведущих специалистов по антикоагулянтной терапии профессора Терлика: «Противопоказанием для назначения антикоагулянтной терапии является незнание патофизиологии тромбогеморрагических состояний и фаркмакологии антикоагулянтов». Эффективность препарата в руках знающего специалиста приносит необычайно положительные результаты; в руках же специалиста, не владеющего достаточными знаниями, применение антикоагулянтов может представлять дополнительную опасность для жизни пациентов».
Литература:
1. Воробьев А.В. Злокачественные заболевания и тромбозы. Вопросы акушерства, гинекологии и перинатологии. 2008; 2 (7): 18-25.
2. Макацария А.Д., Воробьев А.В., Чабров А.М. Значение оценки маркеров тромбофилии при проведении химио- и лучевой терапии у онкологических больных. Материалы Российского Медицинского Форума-2006 «Фундаментальная наука и практика», 18-20 октября 2006 г.
3. Макацария А.Д., Воробьев А.В., Бицадзе В.О. Злокачественные новообразования, тромбофилия, тромбозы. Монография. М. 2008; 650 с.
4. Цыб А.Ф., Сушкевич Г.Н., Балуда М.В., Воробьев А.В., Чабров А.М. Принципы профилактики тромботических осложнений у онкологических больных (солидные образования). Пособие для врачей. Обнинск. 2008; 42 с.
5. Agnelli G., Bergqvist D., Cohen A. et al. Randomized doubleblind study to compare the efficacy and safety of postoperative fondaparinux (Arixtra) and preoperative dalteparin in the prevention of venous thromboembolism after high-risk abdominal surgery: the PEGASUS Study [abstract]. Blood. 2003; 102: 15a.
6. Altinbas M., Coskun H.S., Er O., Ozkan M., Eser B., Unal A., Cetin M., Soyuer S. A randomized clinical trial of combination chemotherapy with and without low-molecular-weight heparin in small cell lung cancer. J. Thromb. Haemost. 2004; 2: 1266-71.
7. Ansell J., Hirsh J., Poller L., Bussey H., Jacobson A., Hylek E.The pharmacology and management of the vitamin K antagonists: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004 Sep; 126 (3): 204-233. Erratum in: Chest. 2005 Jan; 127 (1): 415-6.
8. Bergqvist D., Agnelli G., Cohen A.T. et al. Dura-tion of prophylaxis against venous thrombo-embolism with enoxaparin after surgery for cancer. N. Engl. J. Med. 2002; 346: 975-980.
9. Bona R.D. Hickcy A.D. Wallace D.M. Warfarin is safe as secondary prophylaxis in patients with cancer and a previous episode of venous thrombosis. Am. J. Clin. Oncol. 2000: 23: 71-73.
10. Borsig L., Wong R., Feramisco J. Heparin and cancer revisited: Mechanistic connections involving platelets, P-selectin, carcinoma mucins, and tumor metastasis. Proc. Natl. Acad. Sci. 2001; 98: 3352-3357.
11. Buller H.R., Agnelli G., Hull R.D., Hyers T.M., Prins M.H., Raskob G.E. Antithrombotic therapy for venous thromboembolic disease: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004 Sep; 126 (3): 401-428.
12. Dolovich L., Ginsberg J.S., Douketis J.D. et al. A meta-analysis comparing low molecular weight heparins to unfractionated heparin in the treatment of venous thromboembolism: examining some unanswered questions regarding location of treatment, product type, and dosing frequency. Arch. Intern. Med. 2000; 160: 181-188.
13. Eikelboom J.W., Hirsh J. Combined antiplatelet and anticoagulant therapy: clinical benefits and risks. J. Thromb. Haemost. 2007; 5 (1): 255-63.
14. Falanga A. Mechanism of hypercoagulation in malignancy and during chemotherapy. Haemostasis. 1998; 28 (3): 50-60.
15. Gouin-Thibault I., Achkar A., Samama M.M. The thrombophilic state in cancer patients. Acta Haematol. 2001; 106 (1-2): 33-42.
16. Kakkar A.K., Levine M.N., Kadziola Z., Lemoine N.R., Low V., Patel H.K., Rustin G., Thomas M., Quigley M., Williamson R.C. Low molecular weight heparin, therapy with dalteparin, and survival in advanced cancer: the fragmin advanced malignancy outcome study (FAMOUS). J. Clin. Oncol. 2004; 22: 1944-8.
17. Kearon C., Ginsberg J.S., Kovacs M. et al. Comparison of low-intensity warfarin therapy with conventional intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism. N. Engl. J. Med. 2003; 349:631-639.
18. Kleber F.X., Flosbach C.W., Koppenhagen K. Comparison of the low molecular weight heparin enoxaparin with unfractionated heparin in the prevention of venous thromboembolic events in patients with heart failure NYHA III/IV (PRINCE II study). Circulation. 1999; 100 (1): 1-619.
19. Klerk C.P., Smorenburg S.M., Otten H.M., Lensing A.W., Prins M.H., Piovella F., Prandoni P., Bos M.M., Richel D.J., van T.G., Buller H.R. The effect of low molecular weight heparin on survival in patients with advanced malignancy. J. Clin. Oncol. 2005; 23: 2130-5.
20. Lee A.Y., Levine M.N., Baker R.I. et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N. Engl. J. Med. 2003; 349: 146-153.
21. Levine M.N., Lee A.Y. Treatment of venous thrombosis in the cancer patient. Acta Haematol. 2001; 106 (1-2): 81-87.
22. Ludwig R.J., Alban S., Bistrian R., Boehncke W.H., Kaufmann R., Henschler R., Gille J. The ability of different forms of heparins to suppress P-selectin function in vitro correlates to their inhibitory capacity on bloodborne metastasis in vivo. Thromb. Haemost. 2006; 95: 535-40.
23. Monreal M., Davant E. Thrombotic complications of central venous catheters in cancer patients. Acta Haematol. 2001; 106 (1-2): 69-72.
24. Nasir F.A., Patel H.K., Scully M.F., Fareed J., Lemoine N.R., Kakkar A.K. The low molecular weight heparins dalteparin sodium inhibits angiogenesis and induces apoptosis in an experimental tumour model (abstract 2993). Blood. 2003; 102.
25. Samama M.M. An epidemiologic study of risk factors for deep vein thrombosis in medical outpatients: the Sirius study. Arch. Intern. Med. 2000; 160: 3415-20.
26. Shaker A. Mousa. Low-Molecular-Weight Heparin in Thrombosis and Cancer. Seminars in thrombosis and hemostasis. 2004; 30: 25-29.
27. Vorobiev A.V., Makatsaria A.D., Chabrov A.M. Thrombophilia markers in cancer patients during chemotherapy and radiation therapy. Pathophysiology of haemostasis and thrombosis. 2006; 35 (1-2): A20.
28. von Tempelhoff G.F., Harenberg J., Niemann F. et al. Effect of low molecular weight heparin (certoparin) versus unfractionated heparin on cancer survival following breast and pelvic cancer surgery: a prospective randomized double-blind trial. Int. J. Oncol. 2000; 16: 815-82.
References:
1. Vorobev A.V. Voprosy akusherstva, ginekologii i perinatologii. 2008; 2 (7): 18-25.
2. Makatsariya A.D., Vorob-ev A.V., Chabrov A.M. Estimation value of markers of thrombophilia during chemo-and radiotherapy in cancer patients. Materials Russian Medical Forum-2006 «Basic Science and Practice» [Znachenie otsenki markerov trombofilii pri provedenii khimio- i luchevoi terapii u onkologicheskikh bol-nykh. Materialy Rossiiskogo Meditsinskogo Foruma-2006 «Fundamental-naya nauka i praktika»]. October 18-20, 2006.
3. Makatsariya A.D., Vorob-ev A.V., Bitsadze V.O. Malignant neoplasms, thrombophilia, thrombosis. Monograph [Zlokachestvennye novoobrazovaniya, trombofiliya, trombozy. Monografiya]. Moscow. 2008; 650 s.
4. Tsyb A.F., Sushkevich G.N., Baluda M.V., Vorob-ev A.V., Chabrov A.M. Principles of prevention of thrombotic complications in patients with cancer (solid tumors). Manual for physicians. Obninsk [Printsipy profilaktiki tromboticheskikh oslozhnenii u onkologicheskikh bol-nykh (solidnye obrazovaniya). Posobie dlya vrachei]. Obninsk. 2008; 42 s.
5. Agnelli G., Bergqvist D., Cohen A. et al. Randomized doubleblind study to compare the efficacy and safety of postoperative fondaparinux (Arixtra) and preoperative dalteparin in the prevention of venous thromboembolism after high-risk abdominal surgery: the PEGASUS Study [abstract]. Blood. 2003; 102: 15a.
6. Altinbas M., Coskun H.S., Er O., Ozkan M., Eser B., Unal A., Cetin M., Soyuer S. A randomized clinical trial of combination chemotherapy with and without low-molecular-weight heparin in small cell lung cancer. J. Thromb. Haemost. 2004; 2: 1266-71.
7. Ansell J., Hirsh J., Poller L., Bussey H., Jacobson A., Hylek E.The pharmacology and management of the vitamin K antagonists: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004 Sep; 126 (3): 204-233. Erratum in: Chest. 2005 Jan; 127 (1): 415-6.
8. Bergqvist D., Agnelli G., Cohen A.T. et al. Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N. Engl. J. Med. 2002; 346: 975-980.
9. Bona R.D. Hickcy A.D. Wallace D.M. Warfarin is safe as secondary prophylaxis in patients with cancer and a previous episode of venous thrombosis. Am. J. Clin. Oncol. 2000: 23: 71-73.
10. Borsig L., Wong R., Feramisco J. Heparin and cancer revisited: Mechanistic connections involving platelets, P-selectin, carcinoma mucins, and tumor metastasis. Proc. Natl. Acad. Sci. 2001; 98: 3352-3357.
11. Buller H.R., Agnelli G., Hull R.D., Hyers T.M., Prins M.H., Raskob G.E. Antithrombotic therapy for venous thromboembolic disease: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004 Sep; 126 (3): 401-428.
12. Dolovich L., Ginsberg J.S., Douketis J.D. et al. A meta-analysis comparing low molecular weight heparins to unfractionated heparin in the treatment of venous thromboembolism: examining some unanswered questions regarding location of treatment, product type, and dosing frequency. Arch. Intern. Med. 2000; 160: 181-188.
13. Eikelboom J.W., Hirsh J. Combined antiplatelet and anticoagulant therapy: clinical benefits and risks. J. Thromb. Haemost. 2007; 5 (1): 255-63.
14. Falanga A. Mechanism of hypercoagulation in malignancy and during chemotherapy. Haemostasis. 1998; 28 (3): 50-60.
15. Gouin-Thibault I., Achkar A., Samama M.M. The thrombophilic state in cancer patients. Acta Haematol. 2001; 106 (1-2): 33-42.
16. Kakkar A.K., Levine M.N., Kadziola Z., Lemoine N.R., Low V., Patel H.K., Rustin G., Thomas M., Quigley M., Williamson R.C. Low molecular weight heparin, therapy with dalteparin, and survival in advanced cancer: the fragmin advanced malignancy outcome study (FAMOUS). J. Clin. Oncol. 2004; 22: 1944-8.
17. Kearon C., Ginsberg J.S., Kovacs M. et al. Comparison of low-intensity warfarin therapy with conventional intensity warfarin therapy for long-term prevention of recurrent venous thromboembolism. N. Engl. J. Med. 2003; 349:631-639.
18. Kleber F.X., Flosbach C.W., Koppenhagen K. Comparison of the low molecular weight heparin enoxaparin with unfractionated heparin in the prevention of venous thromboembolic events in patients with heart failure NYHA III/IV (PRINCE II study). Circulation. 1999; 100 (1): 1-619.
19. Klerk C.P., Smorenburg S.M., Otten H.M., Lensing A.W., Prins M.H., Piovella F., Prandoni P., Bos M.M., Richel D.J., Van T.G., Buller H.R. The effect of low molecular weight heparin on survival in patients with advanced malignancy. J. Clin. Oncol. 2005; 23: 2130-5.
20. Lee A.Y., Levine M.N., Baker R.I. et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N. Engl. J. Med. 2003; 349: 146-153.
21. Levine M.N., Lee A.Y. Treatment of venous thrombosis in the cancer patient. Acta Haematol. 2001; 106 (1-2): 81-87.
22. Ludwig R.J., Alban S., Bistrian R., Boehncke W.H., Kaufmann R., Henschler R., Gille J. The ability of different forms of heparins to suppress P-selectin function in vitro correlates to their inhibitory capacity on bloodborne metastasis in vivo. Thromb. Haemost. 2006; 95: 535-40.
23. Monreal M., Davant E. Thrombotic complications of central venous catheters in cancer patients. Acta Haematol. 2001; 106 (1-2): 69-72.
24. Nasir F.A., Patel H.K., Scully M.F., Fareed J., Lemoine N.R., Kakkar A.K. The low molecular weight heparins dalteparin sodium inhibits angiogenesis and induces apoptosis in an experimental tumour model (abstract 2993). Blood. 2003; 102.
25. Samama M.M. An epidemiologic study of risk factors for deep vein thrombosis in medical outpatients: the Sirius study. Arch. Intern. Med. 2000; 160: 3415-20.
26. Shaker A. Mousa. Low-Molecular-Weight Heparin in Thrombosis and Cancer. Seminars in thrombosis and hemostasis. 2004; 30: 25-29.
27. Vorobiev A.V., Makatsaria A.D., Chabrov A.M. Thrombophilia markers in cancer patients during chemotherapy and radiation therapy. Pathophysiology of haemostasis and thrombosis. 2006; 35 (1-2): A20.
28. Von Tempelhoff G.F., Harenberg J., Niemann F. et al. Effect of low molecular weight heparin (certoparin) versus unfractionated heparin on cancer survival following breast and pelvic cancer surgery: a prospective randomized double-blind trial. Int. J. Oncol. 2000; 16: 815-82.
Thrombophilia, thrombosis and antithrombotic therapy in cancer patients
Vorobev A.V., Makatsaria A.D.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Abstract: the clinical lection describes current views about pathogenesis of thrombotic complications in cancer patients. At the same time the risk of iatrogenic thrombophilia under the conditions of radio-, chemotherapy and hormone replacement therapy is considered. Issues concerning scientific explanation of antithrombotic prophylaxis with LMWH are given.
Key words: pathogenesis of thrombotic complications, cancer patients, thrombosis prevention, hemostasis abnormalities, low molecular weight heparin, unfractionated heparin. |
|