ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ НАТУРАЛЬНОГО ПРОГЕСТЕРОНА В АКУШЕРСКОЙ ПРАКТИКЕ
Бицадзе В.О., Акиньшина С.В., Хизроева Д.Х., Макацария Н.А., Стулева Н.С., Машкова Т.М. Дата публикации на сайте: 2014-08-14 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Прогестерон является главным гормоном беременности, который абсолютно необходим для завершения секреторной трансформации эндометрия и его подготовки к имплантации эмбриона, а в дальнейшем – для развития и сохранения беременности. А важнейший органмишень для этого гормона – матка, где эффекты прогестерона направлены на поддержание децидуальной оболочки и где прогестерон выступает в качестве мощного релаксанта гладкомышечных элементов миометрия, кровеносных сосудов и других органов, обеспечивая их адаптацию к беременности.
THE PATHOGENETIC BASIS FOR USING NATURAL PROGESTERONE THERAPY IN OBSTETRIC PRACTICE Bitsadze V.O., Akinshina S.V., Khizroeva J.Kh., Makatsariya N.A., Stuleva N.S., Mashkova T.Ya.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Abstract: Progesterone is a natural female hormone. Called “the pregnancy hormone,” it is essential before and during pregnancy. After ovulation occurs, the ovaries start to produce progesterone needed by the uterus. Progesterone causes the uterine lining or endometrium to thicken. This helps prepare a supportive environment in your uterus for a fertilized egg.A supply of progesterone to the endometrium continues to be important during pregnancy. Following a successful implantation, progesterone helps maintain a supportive environment for the developing fetus.
Key words: pregnancy, progesterone, miscarriage.
Ключевые слова: беременность, прогестерон, невынашивание беременности.
ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава РФ, Москва
Прогестерон был синтезирован в 1934 г. и применяется уже более полувека. В 1935 г. за разработку методики синтеза прогестерона A. Butenandt и его группа были удостоены Нобелевской премии. Название этого гормона второй фазы менструального цикла отражает основную точку его приложения в организме: «pro gestatio» («для беременности»). Прогестерон является главным гормоном беременности, который абсолютно необходим для завершения секреторной трансформации эндометрия и его подготовки к имплантации эмбриона, а в дальнейшем – для развития и сохранения беременности. На протяжении первых трех месяцев гестационного периода основным источником этого гормона выступают яичники (желтое тело беременности), а затем – плацента.
Человечество долго не могло решить проблему доставки натурального прогестерона в организм, что является необходимым компонентом патогенетической терапии при прогестерондефицитных состояниях. Это удалось сделать лишь в 1935 г. Адольфу Бутенанду, автору разработки инъекционного масляного раствора прогестерона, за что он получил Нобелевскую премию. Но после создания масляного раствора прогестерона появилась новая задача – найти менее болезненный, более приемлемый для длительного использования способ доставки (в сравнении с инъекциями масляного прогестерона). Своего рода промежуточным этапом на пути к доставке натурального (идентичного эндогенному) прогестерона в организм стало создание синтетических гестагенов. Так, например, дидрогестерон был синтезирован в 1961 г. Но поиск пути введения в организм идентичного эндогенному прогестерона продолжался. И лишь спустя почти 20 лет, в 1980 г. была открыта уникальная технология микронизации, позволившая обеспечить доставку в организм именно натурального прогестерона безинъекционным способом [12].
Микронизация прогестерона с заключением его в носители липосферы увеличивает степень абсорбции и решает проблему биодоступности прогестерона. Примером препарата микронизированного прогестерона являтся широко известный всем Утрожестан – натуральный прогестерон в желатиновых капсулах для перорального и вагинального применения. А натуральный прогестерон с высокой степенью биодоступности обладает множеством преимуществ по сравнению с другими гестагенными препаратами. Существующие на сегодняшний день препараты, обладающие прогестагенным эффектом, классифицированы на натуральные и синтетические.
Натуральный прогестерон:
– пероральные/вагинальные капсулы (микронизированный прогестерон – Утрожестан), вагинальные гели, масляный раствор для инъекций.
Синтетические прогестагены:
структурно сходные с прогестероном:
– прегнановые производные: ацетилированные (медроксипрогестерона ацетат, мегестрола ацетат, ципротерона ацетат, хлормадинона ацетат, медрогестон); неацетилированные (дидрогестерон);
– непрегнановые производные (демегестон, промегестон, номегестрола ацетат);
структурно сходные с тестостероном:
– этинилированные: эстрановые производные (норэтиндронпримолютнор, норэтинодрел, линестенол, норэтиндрона ацетат, этинодиола диацетат); гонановые производные (левоноргестрел, дезогестрел, гестоден, норгестимат);
– неэтинилированные (диеногест).
Натуральный микронизированный прогестерон Утрожестан получают из растительного сырья диоженина, которое экстрагируется из мексиканского растения дикий Ямс. Однако в термине натуральный прогестерон заложено вовсе не растительное происхождение сырья для производства, а именно 100%-ное структурное сходство молекулы препарата с эндогенным прогестероном, что обеспечивает идентичность действия гормона организма и препарата.
Таким образом, одной из главных особенностей Утрожестана является его метаболизм, абсолютно идентичный метаболизму эндогенного (яичникового) прогестерона, что предопределено его химической формулой, которая не отличается от таковой эндогенного прогестерона (см. рис. 1)
 | Рисунок 1: Утрожестан® – натуральный прогестерон. |
При вагинальном пути введения удается быстро создать необходимые концентрации прогестерона в тканях матки. Bulletti с соавт. подробно описали механизм «первичного прохождения через матку» (непосредственная прямая доставка прогестерона из влагалища в матку), что объясняет преимущество таргетного действия Утрожестана при вагинальном применении. Это позволяет добиться максимальной эффективности прогестерона при минимальных побочных эффектах.
Утрожестан используют для лечения различных гинекологических и акушерских патологий. В гинекологии Утрожестан эффективен в лечении таких заболеваний как гиперплазия эндометрия, дисфункциональные маточные кровотечения, аменорея, недостаточность лютеиновой фазы, предменструальный синдром, а также этот препарат применяют в составе заместительной гормональной терапии менопаузальных расстройств. В акушерской практике натуральный микронизированный прогестерон (Утрожестан) используют при угрозе выкидыша, привычном невынашивании беременности и с целью профилактики преждевременных родов [1,7]. Прогестерон особенно эффективен при беременности, наступившей на фоне нарушений иммунной системы, нейрообменно-эндокринных расстройств, а также при повышенной сократимости миометрия.
Структура и свойства натурального прогестерона
Прогестерон – стероидный гормон из группы С21-стероидов. Его источником в организме женщины вне беременности являются яичники и кора надпочечных желез.
Он образуется из холестерина во всех стероидпродуцирующих клетках. В ходе овариально-менструального цикла и при беременности возникают временные образования, вырабатывающие прогестерон – желтое тело и трофобласт. В норме в течение лютеиновой фазы менструального цикла эндогенная концентрация прогестерона повышается до 25 нг/мл. Прогестерон циркулирует в крови в значительной степени в связанном с транспортным белком состоянии. Большая часть его связана с альбумином, около 20% – с кортикостероидсвязывающим глобулином. Однако, несмотря на высокий уровень связывания с белком, период полураспада прогестерона в сыворотке относительно короткий – 5 мин. Биологический эффект оказывает несвязанный или свободный прогестерон посредст-вом связывания со специфическими ядерными прогестероновыми рецепторами. Выделено два типа прогестероновых рецепторов – А и Б.
Прогестерон расщепляется на большое количество метаболитов. Основные этапы метаболизма – сокращение двойной связи в С4 и в оксидных группах С3 и С20, гидроксилирование на уровне С16 и С21. Метаболиты конъюгируются сульфатами и глюкуронидами и экскретируются мочой. Наиболее важные метаболиты, циркулирующие в крови, – это 17α-гидроксипрогестерон, 11-дезоксикортикостерон и 20-дигидропрогестерон. Биотрансформация прогестерона в дезоксикортикостерон происходит, главным образом, в почках и она пропорциональна концентрации прогестерона в сыворотке крови. Дезоксикортикостерон – предшественник альдостерона. Он обладает сильным минералокортикоидным эффектом, который обычно перекрывается антиминералокортикоидной активностью молекулы прогестерона. Антиминералокортикоидная активность 200 мг перорального микронизированного прогестерона равна активности 25-50 мг спиронолактона. Таким образом, в результате всех взаимодействий натуральный микронизированный прогестерон профилактирует задержку жидкости в организме женщины.
Следует отметить, что естественные метаболиты прогестерона 5β-прегненолон, 5β-прегнадион обладают свойствами усиливать токолитические эффекты натурального прогестерона. А 5α-метаболиты, в т.ч. 5α-прегнанолон, связываются с GABA-рецепторами головного мозга, оказывая нейропротекторное, анксиолитическое и седативное действие.
Таким образом, 5α и 5β – естественные метаболиты натурального прогестерона – оказывают токолитический и анксиолитический эффект.
Вне беременности синтез прогестерона во вторую фазу цикла является показателем овуляторных циклов и способности женщины к зачатию. Прогестерон оказывает множественное воздействие на организм, но все же основное его влияние – это ежемесячная подготовка половых органов женщины к беременности. Если беременность не наступила, желтое тело подвергается обратному развитию и в ответ на резкое снижение уровня половых гормонов происходит менструация.
Принято выделять две группы тканей-мишеней для половых гормонов: репродуктивные и нерепродуктивные (см. табл. 1).
Таблица 1. Ткани-мишени для половых гормонов.
| Репродуктивные | Нерепродуктивные |
|---|
Половой тракт
Гипоталамус и гипофиз
Молочные железы | Мозг
Сердечнососудистая система
Уретра и мочевой пузырь
Кожа и волосы
Толстый кишечник
Печень (метаболизм стероидов, связывание метаболитов гормонов) |
Нарушение секреции прогестерона происходит при ановуляции или отсутствии желтого тела и, соответственно, прогестерона. В таких случаях в крови определяют лишь незначительные концентрации прогестерона, синтезируемого в надпочечниках. Это состояние называется гипофункцией желтого тела или недостаточностью лютеиновой фазы (НЛФ) и клинически может проявляться бесплодием, предменструальным синдромом, мастопатией или циклической мастодинией, развитием гиперплазии эндометрия. При наступлении беременности недостаточность прогестерона может стать причиной угрозы прерывания или невынашивания беременности, а также начала самопроизвольных преждевременных родов.
Основные биологические эффекты натурального прогестерона
Влияние прогестерона на эндометрий. Физиологический эффект прогестерона вне беременности заключается, в первую очередь, в секреторной трансформации эндометрия. Он тормозит вызванную эстрогенами пролиферацию слизистой, стимулирует секрецию эндометриальными железами богатой гликогеном слизи и путем разрыхления субгландулярной стромы подготавливает слизистую к имплантации бластоцисты. Вне беременности прогестерон синтезируется, в основном, желтым телом. За сутки оно секретирует до 25 мг прогестерона. При беременности активность желтого тела на ранней стадии эмбриогенеза поддерживает трофобласт, который продуцирует хорионический гонадотропин человека (ХГЧ). Под действием ХГЧ желтое тело синтезирует и секретирует прогестерон в достаточном количестве, чтобы предотвратить отторжение эндометрия. В противном случае отторжение произойдет через 10-12 сут. после овуляции.
Влияние прогестерона на слизистую оболочку влагалища. Прогестерон ингибирует вызываемую эстрогенами пролиферацию и корнификацию эпителия слизистой влагалища, уменьшает образование и повышает вязкость шеечной слизи.
Влияние прогестерона на молочные железы. В молочных железах гормон оказывает влияние на железистоальвеолярные структуры, подавляет пролиферативный и секреторный процессы в протоках молочных желез.
Влияние прогестерона на водносолевой обмен (антиальдостероновый эффект). Помимо специфической гестагенной активности прогестерон оказывает достаточно выраженный антиминералокортикоидный эффект, который обусловлен конкурентным взаимодействием с рецепторами альдостерона [11].
Благодаря наличию в молекуле двойной связи между 4-м и 5-м атомами углерода прогестерон проявляет значительное, сравнимое со спиронолактоном, сродство к рецепторам альдостерона в канальцах почек, эндотелии коронарных и других сосудов. В этом отношении он практически не имеет конкурентов среди других прогестинов. Конкуренцией с альдостероном за места связывания на молекуле рецептора объясняется выраженная способность прогестерона усиливать диурез и экскрецию натрия с мочой. Тем самым он препятствует задержке избытка жидкости, которую в организме беременной женщины провоцируют эстрогены и минералокортикоиды.
Биологические эффекты естественных метаболитов натурального прогестерона
Влияние на миометрий и гладкомышечную ткань. Важнейший механизм токолитического действия прогестерона состоит в том, что его естественные метаболиты, такие как 5α-прегнандион, способны ингибировать возбуждающее действие эндогенного окситоцина на миометрий путем блокады окситоциновых рецепторов.
Прогестерон благоприятно влияет на апоптоз, клеточную адгезию, пролиферацию клеток эндотелия и гладкой мускулатуры, обеспечивая мобильность стенок сосудов, что важно для нормального функционирования формирующейся плаценты.
Нейропротекторный эффект естественного прогестерона. Естественные метаболиты прогестерона, которые образуются в головном мозге, например, 5α-прегнанолон, способны связываться с GABA рецепторами и воздействуют на ГАМК-ергические структуры мозга, что обеспечивает нейропротекторное действие и положительное влияние на эмоциональную и психическую сферы.
Роль прогестерона в сохранении беременности
Общеизвестна ключевая роль прогестерона в гестационном процессе, в частности, для сохранения беременности. Оплодотворение яйцеклетки и образование трофобласта предотвращают лизис желтого тела. Его структура и гормональная активность поддерживаются и стимулируются хорионическим гонадотропином. Как указывалось выше, прогестерон, вырабатываемый желтым телом беременности во все возрастающем количестве, обеспечивает развитие и сохранение беременности на протяжении первых 8 недель. После 10-й недели основным источником прогестерона становится трофобласт. Динамика содержания прогестерона в крови беременной характеризуется непрерывным ростом: от 25 нг/мл на 5-й день беременности до 130-160 нг/мл в конце 38-й недели. После этого срока уровень гормона снижается. Повышая порог возбудимости маточной мускулатуры, он предотвращает отторжение эмбриона, то есть обеспечивает сохранение беременности. Большое значение имеет иммуносупрессивный эффект прогестерона для обеспечения толерантности иммунной системы материнского организма к антигенам плода.
Беременность и система гемостаза
Патогенез большинства осложнений беременности связан с нарушением процессов имплантации, инвазии трофобласта в децидуальную оболочку, плацентации. Имплантация, инвазия трофобласта и дальнейшее функционирование плаценты представляются многоступенчатым процессом эндотелиально-гемостазиологических взаимодействий, который нарушается при тромботической тенденции и в случае генетических дефектов свертывания.
По нашим данным, в патогенезе синдрома потери плода (СПП) нередко лежит сочетание форм тромбофилии (генетической, приобретенной, гипергомоцистеинемии) с другими факторами, такими как эндокринный фактор [8,9]. Например, при наличии АФС имеет место влияние на β-ХГЧ и вторичное снижение концентрации прогестерона.
В процессе подготовки к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания ингибитора активации плазминогена типа 1 (PAI-1), тканевого фактора (TF) и снижение уровня активатора плазмина тканевого и урокиназного типов, металлопротеаз матрикса и вазоконстриктора – эндотелина 1. Это физиологическая регуляция гемостаза, фибринолиза, экстрацеллюлярного матрикса и сосудистого тонуса, направленная на предотвращение образования геморрагий при дальнейшей инвазии трофобласта. Со своей стороны бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типов и протеазы, которые необходимы для разрушения экстрацеллюлярного матрикса в процессе имплантации. Их синтез, в свою очередь, регулируется хорионическим гонадотропином.
Помимо этого, при нормальном содержании прогестерона происходит взаимодействие с киллер-ингибирующими рецепторами через прогестерониндуцирующий блокирующий фактор (PIBF), что приводит к активации иммунного ответа матери через систему Т-хелперов II типа (Th II). Т-хелперы II типа продуцируют регуляторные цитокины: интерлейкины (ИЛ-3, ИЛ-4, ИЛ-10). Регуляторное действие ИЛ-3 в период имплантации определяет пролиферативную активность цитотрофобласта и фибринолитические процессы в эндометрии (за счет активации урокиназы, превращающей плазминоген в плазмин).
В экспериментах на мышах показано, что урокиназный активатор плазминогена играет важную роль в процессах инвазии трофобласта и перестройки эпителия матки, а также в поддержании равновесия между фибриногеном и фибринолизом в децидуальной ткани. Таким образом, прогестерон посредством Th II и ИЛ-3 влияет также на локальные механизмы гемостаза в эндометрии.
Влияние прогестерона на иммунную систему
Следует остановиться на роли прогестерона в предотвращении иммунного конфликта между организмами матери и эмбриона, что привело бы к его отторжению. Прогестерон проявляет иммуносупрессивную активность, направленную на системы клеточного (Т-лимфоциты) и гуморального (В-лимфоциты) иммунного ответа. В частности, он ингибирует пролиферацию лимфоцитов периферической крови при стимуляции их различными митогенами – фитогемаглютинином, конконавалином-А, а также провоспалительными цитокинами – фактором некроза опухолиa, интерлейкинами-1 и пр., которые являются непосредственными факторами повреждения эндотелия. Во время беременности под влиянием аллогенных антигенов плода резко возрастает количество лимфоцитов периферической крови, имеющих рецепторы к прогестерону, причем относительное содержание таких лимфоцитов при ранних спонтанных абортах и поздних выкидышах значительно ниже, чем при нормально протекающей беременности.
Обнаружен специфический блокирующий фактор, индуцируемый прогестероном (PIBF), который вырабатывается в децидуальной оболочке лимфоцитами CD56+, а также имеющими прогестероновые рецепторы активированными лимфоцитами периферической крови беременной женщины. Он запускает каскад иммунологических процессов, способствующих формированию иммунологической толерантности организма матери по отношению к наследуемым от отца чужим антигенам эмбриона. В частности, благодаря PIBF изменяется Th1/Th2 баланс в сторону усиления продукции цитокинов лимфоцитами Th2 (Il-4, Il-10, которые ассоциируются с нормальным развитием беременности) и подавлением развития Th1 лимфоцитов, продуцирующих провоспалительные цитокины – IL-1, IL-6, TNF-a, которые ассоциируются с осложненным течением беременности повреждением эндотелиальных клеток. На протяжении всей беременности содержание PIBF в крови постоянно растет, а после 40 недель он исчезает из крови (вероятно, в связи с предшествующим резким снижением уровня прогестерона). Таким образом, натуральный прогестерон во время беременности выступает в роли естественного иммунодепрессанта: подавляет развитие Т-лимфоцитов, угнетает их пролиферативный ответ, блокирует реакции клеточной цитотоксичности и снижает эффективность фагоцитоза.
Прогестерон и регуляция уровня андрогенов
Прогестерон способен конкурировать с тестостероном за 5a-редуктазу. Этот фермент превращает тестостерон в значительно более активный андроген – 5a-дигидротестостерон, а прогестерон – в 5a-дигидропрогестерон (5a-прегнандион). Благодаря конкурентным взаимоотношениям прогестерон ослабляет образование активного андрогенного метаболита. Слабый антиандрогенный эффект прогестерона может быть обусловлен еще и тем, что его естественный метаболит прогестерона – 5α-прегнандион – имеет сродство к рецепторам андрогенов и, конкурируя с последними в процессе рецепторного связывания, ослабляет их специфический андрогенный эффект.
Речь идет о двух уровнях регуляции эффекта андрогенов: взаимодействие с ферментом 5α-редуктазой (уменьшение образования самого активного метаболита дигидротестостерона) и взаимодействие естественного метаболита 5α-прегнандиона с рецепторами тестостерона [3,5].
Избыток андрогенов при беременности может неблагоприятно сказаться на развитии плода и обмене веществ. Защитное действие прогестерона в отношении андрогенов материнского организма является достаточно существенным, поскольку во время беременности активизируется образование андрогенных стероидов в коре надпочечников (наряду с кортикостероидами) и они свободно проникают к плоду через плаценту [11]. Кроме того, повышенный уровень эндогенных андрогенов в материнском организме практически неизбежен, если у женщины имеется врожденная гиперплазия коры надпочечников, синдром поликистозных яичников [2,6,10].
Микронизированный прогестерон для перорального применения (мягкие капсулы, содержащие 100 и 200 мг прогестерона в арахисовом масле) мг прогестерона в арахисовом масле) впервые появился во Франции в 1980 г. под торговым названием Утрожестан (разработан фирмой «Besins-Iscovesco», Франция). Сейчас препарат известен во многих странах странах под названиями Утрожестан, Прожестан, Прометриум или Лугестерон [12].
Биодоступность в широком смысле – это количество лекарственного вещества, доходящее до места его действия в организме (т.е. способность препарата усваиваться). Высокая биодоступность прогестерона в составе Утрожестана достигнута благодаря оригинальной технологии микронизации и использованию липофильного растворителя прогестерона. Многие исследования были предприняты для выяснения биодоступности и фармакокинетики прогестерона при пероральном и интравагинальном применении Утрожестана. После однократного перорального приема 200 мг микронизированного прогестерона концентрация гормона в плазме крови испытуемых женщин-добровольцев с отсутствующими яичниками повышалась в течение первого часа с 0,13 до 4,25 нг/мл, достигала пика (11,75 нг/мл) через 2 ч, а через 8 ч снижалась до 1,64 нг/мл. Полупериод нахождения прогестерона в крови во второй (медленной) фазе выведения равен 16-18 ч и не зависит от дозы. По данным R. Morville с соавт. (1982), через 12 ч после приема Утрожестана содержание прогестерона в эндометрии пациенток значительно выше, чем в контрольной группе. Пероральный прием Утрожестана сразу после еды значительно улучшает всасывание прогестерона, что повышает его биодоступность в 2 раза.
Исследуя всасывание и метаболизм прогестерона после перорального приема 100 мг его микронизированной формы у женщин в постменопаузе, M.I. Whitehead с соавт. (1980) показали, что общее всасывание препарата достигает 25%, и эта величина почти соответствует суточной продукции гормона в середине лютеиновой фазы овариального цикла. Другие исследователи получили несколько меньшие величины биодоступности (15-17%), но уровень гормона в крови был близок к таковому в середине лютеиновой фазы.
Хроматографический анализ показал повышение содержания естественных метаболитов прогестерона в плазме, среди которых преобладают прегнандиол, прегнанолон, 20α-дигидропрогестерон, 17α-гидрокси-прогестерон. 20α-дигидропрогестерон имеет достаточно высокую прогестагенную активность, поэтому он пролонгирует гормональные эффекты введенного прогестерона. С учетом времени сохранения эффективной концентрации в крови, метаболизма, распределения и задержки прогестерона в тканях органовмишеней описанный фармакокинетический профиль позволил рекомендовать пероральный прием микронизированного прогестерона два раза в сутки для полноценного проявления его фармакотерапевтического эффекта.
Следует отметить значительную индивидуальную вариабельность основных фармакокинетических параметров при пероральном приеме Утрожестана, таких как максимальная концентрация в плазме и скорость метаболизма прогестерона. Эти различия являются обычными для всех природных и синтетических прогестинов, они определяются индивидуальными особенностями активности ферментов в печени, эндометрии и в других тканях [22].
При интравагиналъном введении Утрожестана прогестерон быстро всасывается и уже через 1 ч достигает высокой концентрации в крови. Максимальное содержание гормона в плазме наблюдается в пределах 2-6 ч. Введение препарата уже в дозе 100 мг утром и вечером поддерживает на протяжении суток концентрацию гормона в среднем на уровне 9,7 нг/мл, что близко к соответствующим величинам у женщин в лютеиновой фазе физиологического овуляторного цикла (4-25 нг/мл). При беременности требуемые концентрации прогестерона существено выше, чем в лютеиновой фазе цикла, поэтому рекомендуемые лечебные дозы составляют 400-600 мг, поддерживающая доза – 200 мг.
В случае интравагинального применения Утрожестана биодоступность прогестерона более высокая по сравнению с пероральным приемом, индивидуальные колебания уровня гормона в крови меньшие, а эффективная концентрация поддерживается более стабильно и продолжительно.
Это является важным фактором эффективного подавления митотической активности и полной секреторной трансформации эндометрия. Основным метаболитом прогестерона при интравагинальном применении является прегнандиол.
Применение Утрожестана
Невынашивание беременности относится к достаточно распространенной патологии, причем в 40% случаев ее причиной является недостаточное образование прогестерона желтым телом, а иногда и плацентой. Неблагоприятная социальноэкономическая и экологическая обстановка, широкое распространение абортов, вредных привычек, инфекционных болезней мочеполовой системы способствуют ранним самопроизвольным абортам и поздним выкидышам.
С целью сохранения беременности при угрозе ее прерывания и для профилактики привычных выкидышей рекомендуется ежедневное интравагинальное применение Утрожестана по 200-400 мг в сутки на протяжении 12 недель. В дальнейшем риск прерывания беременности из-за неполноценности желтого тела снижается, так как функция выработки прогестерона переходит к плаценте. Однако наш опыт свидетельствует, что длительный прием Утрожестана, вплоть до 28-30 недель беременности, значительно снижает риск позднего выкидыша и преждевременных родов, что, по-видимому, связано в том числе и с токолитическими эффектами Утрожестана.
Показаниями для интравагинального применения Утрожестана, кроме невынашивания беременности, являются также бесплодие, связанное с недостаточностью желтого тела, и необходимость поддержки лютеиновой фазы при выполнении вспомогательных репродуктивных технологий. С целью восполнения дефицита прогестерона в спонтанном или индуцированном менструальном цикле Утрожестан назначают по 200-400 мг в сутки в 2 приема, начиная с 16-го дня цикла в течение 10 дней. В случае задержки менструации или при наступлении беременности прием препарата следует возобновить. При использовании Утрожестана в циклах ЭКО его вводят в удвоенной дозе, начиная со дня инъекции хорионического гонадотропина до 12 недель беременности.
У беременных с АФС применение Утрожестана имеет особое значение, поскольку известно, что АФА чрезвычайно гетерогенны как по своей структуре, так и по эффектам: ряд из них обладают анти-ХГЧ-эффектом, то есть подавляют продукцию хорионического гонадотропина, что влечет за собой недостаточную прогестероновую поддержку беременности. Характерно, что в такой ситуации введение извне ХГЧ неэффективно. Таким образом, единственно возможный путь – замещение дефицита прогестерона. Поскольку гормональный препарат должен применяться в условиях тромбофилии, то к нему предъявляются и особенные требования – он не должен обладать потенциально протромботическим эффектом: этому условию отвечает Утрожестан. Поскольку АФА не только на гормональном уровне вмешиваются в течение беременности, изменяют адгезионные свойства предимплантационного эмбриона, а прежде всего изменяют свойства экстрацеллюлярного матрикса слизистой эндометрия и способствуют тромбированию «ранних» сосудов плаценты, абсолютно необходимо назначать Утрожестан не изолированно, а в сочетании с низкомолекулярным гепарином (НМГ) [9].
Утрожестан обладает бесспорным преимуществом для терапии беременных женщин с угрозой прерывания, а также для поддержки лютеиновой фазы в программах оплодотворения in vitro. Капсулы с микронизированным прогестероном являются удобной лекарственной формой для интравагинального применения.
Перечисленные выше свойства натурального прогестерона Утрожестана обусловливают его эффективность и безопасность не только у беременных с эндокринными факторами, но и у беременных с тромбофилией, эндотелиопатией, свойственных гипергомоцистеинемии [8].
«Полезные» особенности Утрожестана как натурального прогестерона у беременных с тромбофилией, в т.ч. и с гипергомоцистеинемией:
1. Отсутствие побочных метаболических влияний на систему гемостаза.
2. Отсутствие побочных эффектов на функцию печени.
3. Отсутствие негативного эффекта на углеводный и липидный обмены.
4. Антицитокиновый эффект (снижение уровня провоспалительных цитокинов IL-1, TNFa).
5. Отсутствие негативного влияния на половую дифференцировку плода.
6. Физиологическая регуляция уровня андрогенов (антиандрогенный эффект).
7. Токолитический эффект.
8. Отсутствие ребаундэффекта.
9. Отсутствие антигонадотропного эффекта.
10. Положительный нейротропный эффект.
В последнее время большое внимание уделяется использованию натурального прогестерона (Утрожестан) при лечении угрозы преждевременных родов.
Предупреждение преждевременных родов стало одной из основных задач перинатальной медицины [4]. Лечение этой патологии состоит в применении медикаментозных средств, среди которых самыми распространенными являются b-миметики. Однако они вызывают развитие некоторых побочных явлений, в основном со стороны сердечно-сосудистой системы матери.
Токолитическое действие натурального прогестерона давно привлекало внимание клиницистов. Для подавления сократительной деятельности матки целесообразно использовать лекарственную форму прогестерона для перорального приема благодаря ее способности увеличивать концентрации прогестерона как в плазме, так и в миометрии.
Прогестерон играет важную роль в обеспечении нормального течения беременности, по образному выражению, является своеобразным протектором беременности. Прогестерон позволяет беременности достигать своих физиологических сроков путем подавления сократительной активности матки. При достаточном количестве в миометрии он блокирует эффект окситоцина и a-адренергическую стимуляцию, тем самым усиливая b-адренергический токолитический эффект. Прогестерон уменьшает количество рецепторов к окситоцину, а также синтез простагландина F2a и количество рецепторов к нему в мышце матки. Прогестерон контролирует концентрацию эстрогенов в миометрии. Контроль уровня эстрогена осуществляется за счет ингибирования ферментов D-Зb-гидроксистероиддегидрогеназы и Зb-стероидсульфатазы, которые участвуют в метаболизме стероидов.
Достаточный уровень прогестерона модифицирует ультраструктурную организацию миометрия путем ингибирования появления межклеточных щелевых соединений. Таким образом, прогестерон ингибирует организацию синцития в миометрии, который способен передавать электрическую стимуляцию и отвечать координированным сокращением мышц.
Токолитическое действие прогестерона:
1. Блокирует эффект окситоцина.
2. Блокирует a-адренергическую стимуляцию.
3. Уменьшает количество рецепторов к окситоцину.
4. Уменьшает синтез и число рецепторов к простагландину F2a.
5. Контроль уровня эстрогенов.
6. Ингибирует образование синцития.
При приеме Утрожестана (400 мг) внутрь отмечались максимальные уровни прогестерона в крови и, в меньшей степени, в плаценте приблизительно через 150 мин. Учитывая доказанное ранее существование градиента концентрации прогестерона в зависимости от близости к плаценте, можно объяснить более высокие уровни прогестерона в участках миометрия, близких к плаценте за счет диффузии гормона из плаценты в миометрии.
Одновременно в плаценте снижается уровень эстрогенов. Локальные изменения эстрогенов в миометрии соответствуют градиенту концентрации, характерному для прогестерона.
Токолитическое действие прогестерона достаточно в 80% случаев для предупреждения преждевременных родов, хотя действие прогестерона, принятого перорально, не такое интенсивное и не такое быстрое, как при внутривенном введении b-миметиков. Уровень прогестерона увеличивается приблизительно на 50% через 1 ч после перорального приема 400 мг микронизированного прогестерона. Число маточных сокращений также уменьшается практически на 50% через 1 ч после начала лечения.
Следующие приемы прогестерона целесообразно назначить через 4-8 ч, в зависимости от степени клинических проявлений угрозы преждевременных родов. В последующие дни препарат назначается каждые 8 ч, затем доза уменьшается до 200-300 мг 3 раза в сутки.
Сочетанное применение b-миметиков и микронизированного прогестерона позволяет значительно сократить время внутривенной инфузии токолитиков (в 1,8-2 раза) и существенно уменьшить их общую дозу (в 3,5 раза). Кроме того, появляется возможность более раннего перехода на удобный пероральный путь приема b-миметиков.
Это позволяет значительно снизить как дозу b-миметиков, так и продолжительность их применения. Снижение дозы назначаемых b-миметиков является чрезвычайно важным, так как эти препараты приводят к опасности развития сердечно-сосудистых осложнений, таких как сердцебиение, повышение артериального давления, диспноэ, отек легких, ишемия миокарда, что крайне важно у пациенток с гипергомоцистеинемией и другими формами тромбофилии, а также при наличии экстрагенитальных заболеваний (сердечно-сосудистые заболевания, заболевания почек, системная красная волчанка, метаболический синдром и пр.). Этих осложнений следует особенно опасаться в случае многоплодной беременности, когда увеличивается объем плазмы и еще больше возрастает опасность сердечно-сосудистых осложнений.
В случае выявления у женщин с метаболическим синдромом (МС) дефицита прогестерона, а также неполноценности лютеиновой фазы (НЛФ) по тестам функциональной диагностики, мы рекомендуем назначать Утрожестан [6,10,13].
Как правило, у пациенток с МС и СПКЯ практически всегда имеет место относительная или абсолютная прогестероновая недостаточность и гиперандрогения [2,10].
Утрожестан обладает эффектом «контроля» за уровнем андрогенов, способностью снижать активность андрогенов при гиперандрогении и сохраненять беременность, а также, что имеет принципиальное значение, не влияет отрицательно на половую дифференцировку мозга плода [17,18,19,21]. Это исключительно важно для дальнейшего правильного развития половой системы ребенка и его репродуктивного и психического здоровья во взрослом периоде жизни [16,20,23].
Независимо от способа введения, микронизированный прогестерон не обладает антигонадотропной активностью и не подавляет продукцию прогестерона яичниками, также не имеет ребаундэффекта при отмене. Важным свойством препарата является отсутствие отрицательного влияния на углеводный и липидный обмен, свертывание крови, артериальное давление (обладает легким гипотензивным действием за счет антиальдостеронового эффекта); благодаря умеренному антиальдостероновому эффекту не вызывает задержку жидкости в организме, не вызывает увеличение массы тела; в отличие от препаратов синтетических прогестинов не способ-ствует развитию депрессии и в отличие от масляного раствора прогестерона (инъекционная форма) отлично переносится [14,15].
Основные метаболиты Утрожестана неотличимы от метаболитов эндогенного прогестерона, поэтому они не имеют непредсказуемых побочных эффектов. Все эти свойства Утрожестана играют важную роль в случае применения его у женщин с ожирением и метаболическим синдромом (см. рис. 2) [13,22].
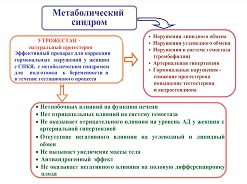 | Рисунок 2: Применение препарата натурального прогестерона (Утрожестан) у женщин с метаболическим синдромом |
Пути введения Утрожестана
Возможны пероральный и вагинальный пути введения Утрожестана. При пероральном введении препарата максимальная концентрация достигается через 2 ч, но затем постепенно снижается, достигая низких значений через 6-7 ч. При вагинальном введении максимальная концентрация достигается через 4-6 ч, но держится на достаточно высоком уровне до 24 ч. Средняя концентрация составляет 9,5-10 нг/мл.
Таким образом, при приеме 200 мг Утрожестана в сутки концентрация препарата соответствует концентрации прогестерона в лютеиновую фазу цикла. При приеме доз, превышающих 200 мг, концентрация прогестерона аналогична таковой в первом триместре беременности.
При вагинальном пути введения Утрожестана повышается биодоступность препарата, Утрожестан накапливается в матке, эндометрии, постепенно повышается уровень прогестерона в плазме крови.
Показания к пероральному применению Утрожестана:
1. Нарушения менструального цикла (олиго, аменорея, дисменорея).
2. Предменструальный синдром.
3. Альгодисменорея.
4. Фибрознокистозная мастопатия.
5. Масталгия, мастодиния.
6. Перименопаузальные расстройства.
7. Прогестероновая проба.
8. Угроза выкидыша.
9. Угроза преждевременных родов.
Показания для использования вагинального пути введения:
1. Эндокринное бесплодие.
2. Угрожающий выкидыш.
3. Профилактика привычного выкидыша.
4. Репродуктивные технологии.
5. Регуляция менструального цикла при миоме матки, эндометриозе.
После проведения стимуляции суперовуляции и переноса эмбриона очень важна поддержка желтого тела. Вопервых, возможен исходный дисбаланс у ряда женщин, во-вторых, аГнРг активируют 20-альфагидроксистероиддегидрогеназу, которая способствует расщеплению прогестерона и накоплению 20-альфагидроксипрогестерона. Кроме того, более высокий уровень эстрадиола в цикле стимуляции овуляции требует и более высокого уровня прогестерона для сохранения нормального соотношения эстрадиол/прогестерон. К тому же, низкий уровень эндогенного ЛГ при применении агонистов гонадолиберина является причиной неполноценного желтого тела.
Прием Утрожестана должен быть продолжен, если беременность наступила на фоне приема Утрожестана.
Утрожестан применяют в дозе 200-400 мг с 17-го по 26-й день цикла зачатия, при наступившей беременности – до 12-20-й недели беременности, в зависимости от клинической картины. При наличии диагностированной гиперандрогении – до 24-й недели. Пациенткам с гиперандрогенией рекомендуется обязательное назначение Утрожестана с момента установления беременности или в циклах зачатия с целью купирования относительной гиперэстрогенемии, обусловленной периферической конверсией андрогенов в эстрогены [14,15].
Заключение
Доказана эффективность Утрожестана при различных формах эндокринного бесплодия, для поддержки имплантации эмбрионов и сохранения беременности в первом триместре, при осуществлении экстракорпорального оплодотворения в программе донации яйцеклеток, а также при экстракорпоральном оплодотворении и стимулировании циклов аналогами ГнРГ. Препарат не повышает риск развития гиперстимуляции и более удобен в применении по сравнению с ежедневными инъекциями прогестерона. Утрожестан эффективен при предменструальном синдроме, дисфункциональных маточных кровотечениях, вторичной аменорее и контроле за ростом эндометрия, характеризуется лучшим профилем безопасности в отношении влияния на процессы обмена, по сравнению с другими синтетическими прогестинами.
Микронизированный прогестерон (Утрожестан, Прожестан, Прометриум или Лугестерон) обладает достаточной биодоступностью не только при вагинальном способе введения, но и при пероральном приеме.
В результате проведения ряда контролируемых исследований сравнительной эффективности Утрожестана, плацебо или синтетических прогестинов установлено, что Утрожестан в оптимальных дозах не оказывает отрицательного воздействия на обмен липидов, толерантность к глюкозе, свертываемость крови, массу тела или уровень АД [6,13]. Выбор пути введения позволяет индивидуально регулировать выраженность анксиолитического действия микронизированного прогестерона (от более выраженного седативного при пероральном приеме до лишь мягкого противотревожного при вагинальном), что также является его дополнительным преимуществом.
Литература:
1. Баймурадова С.М. Патогенез, принципы диагностики, профилактики и терапии синдрома потери плода, обусловленного приобретенными и генетическими дефектами гемостаза. Дис. …докт. мед. наук. М. 2006; 291 с.
2. Беляков Н.А., Сеидова Г.Б., Чубриева С.Ю., Глухов Н.В. Метаболический синдром у женщин (патофизиология и клиника). СПб. 2005. 440 с.
3. Богданова Е.А., Телунц А.В. Гирсутизм у девочек и молодых женщин. М. 2002; 96 с.
4. Бурчинский С.Г. Проблема дефицита магния в организме: методы фармакологической коррекции. Здоровье Украины. 2004; 3.
5. Вирилизм. Эндокринные заболевания и синдромы. Под редакцией М.С. Бирюковой. М. 2000; 9-32.
6. Дмитриев А.Н. Ожирение и метаболический синдром. Екатеринбург. 2001; 160 c.
7. Доброхотова Ю.Э. Утрожестан в лечении невынашивания беременности. М. 2005; 6-13.
8. Макацария А.Д., Белобородова Е.В., Баймурадова С.М., Бицадзе В.О. Гипергомоцистеинемия и осложнения беременности. М. 2005; 147-180.
9. Макацария А.Д., Бицадзе В.О. Тромбофилии и противотромботическая терапия в акушерской практике. М. 2003; 904 с.
10. Манухин И.Б., Геворкян М.А. и соавт. Метаболические нарушения у женщин с синдромом поликистозных яичников. Проблемы репродукции. 1999;4: 7-13.
11. Назаренко Т.А., Дуринян Э.Р., Байбарина Г.В. Гиперандрогения. Практическое руководство. М. 2004; 3-5.
12. Резников А.Г. Препараты прогестерона: фармакологические особенности, преимущества, клиническое применение. Практикующий врач. 2004; 3: 5.
13. Balen A.H. et al Polycystic ovary syndrome. London and New York. 2005; 256 p.
14. Eckel Robert H. Obesity: mechanisms and clinical management. Philadelphia. 2003; 378-398.
15. Furukawa S., Fujita T., Shimabukuro M. et al. Increased oxidative stress in obesity and its impact on metabolic syndrome. The Journal of Clinical Investigation. 2004; 114 (12): 1752-1761.
16. Kruijver F.P. Zhou J.N., Pool C.W., Hofman M.A., Gooren L.J., Swaab D.F: Male-to-female transsexuals have female neuron numbers in a limbic nucleus. J. Clin. Endocrinol. Metab. 2000; 85: 2034-2041.
17. Swaab D.F: The human hypothalamus. Basic and Clinical Aspects. Part I: Nuclei of the Hypothalamus. Handbook of Clinical Neurology; in Aminoff M.J., Boller F., Swaab D.F. (ed. Amsterdam. 2003; 79.
18. Swaab D.F., Fliers E. A sexually dimorphic nucleus in the human brain. Science. 1985; 228: 1112-1115.
19. Swaab D.F. Sexual differentiation of the human brain: Relevance for gender identity, transsexualism and sexual orientation. Gynecol. Endocrinol. 2004; 19: 301-312.
20. Swaab D.F., Hofman M.A. An enlarged suprachiasmatic nucleus in homosexual men. Brain Res. 1990; 537: 141-148.
21. Swaab D.F. The Human Hypothalamus. Basic and Clinical Aspects. Part II: Neuropathology of the hypothalamus and adjacent brain structures. Handbook of Clinical Neurology. Amsterdam. 2004.
22. Takaya J., Higashino H., Kobayashi Y. Intracellular magnesium and insulin resistance. Magnes. Res. 2004 Jun; 17 (2): 126-36.
23. Zhou J.N., Hofman M.A., Gooren L.J., Swaab D.F. A sex difference in the human brain and its relation to transsexuality. Nature. 1995; 378: 68-70.
References:
1. Baimuradova S.M. Patogenez, printsipy diagnostiki, profilaktiki i terapii sindroma poteri ploda, obuslovlennogo priobretennymi i geneticheskimi defektami gemostaza. Doct, Diss (Pathogenesis, principles of diagnosis, prevention and treatment of the syndrome of fetal loss due to genetic defects and acquired hemostasis). Dr. diss. Moscow. 2006; 291 s.
2. Belyakov N.A., Seidova G.B., Chubrieva S.Yu., Glukhov N.V. Metabolic syndrome in women (pathophysiology and clinical) [Metabolicheskii sindrom u zhenshchin (patofiziologiya i klinika)]. St. Petersburg. 2005. 440 s.
3. Bogdanova E.A., Telunts A.V. Hirsutism in girls and young women [Girsutizm u devochek i molodykh zhenshchin]. Moscow. 2002; 96 s.
4. Burchinskii S.G. Zdorov’e Ukrainy. 2004; 3.
5. Virilism. Endocrine diseases and syndromes. Edited by M.S. Biryukova [Virilizm. Endokrin-nye zabolevaniya i sindromy. Pod redaktsiei M.S. Biryukovoi]. Moscow. 2000; 9-32.
6. Dmitriev A.N. Obesity and metabolic syndrome [Ozhirenie i metabolicheskii sindrom]. Ekaterinburg. 2001; 160 c.
7. Dobrokhotova Yu.E. Utrozhestan in the treatment of miscarriage [Utrozhestan v lechenii nevynashivaniya beremennosti]. Moscow. 2005; 6-13.
8. Makatsariya A.D., Beloborodova E.V., Baimuradova S.M., Bitsadze V.O. Hyperhomocysteinemia and pregnancy complications [Gipergomotsisteinemiya i oslozhneniya beremennosti]. Moscow. 2005; 147-180.
9. Makatsariya A.D., Bitsadze V.O. Thrombophilia and antithrombotic therapy in obstetric practice [Trombofilii i protivotromboticheskaya terapiya v akusherskoi praktike]. Moscow. 2003; 904 s.
10. Manukhin I.B., Gevorkyan M.A. i soavt. Problemy reproduktsii. 1999; 4: 7-13.
11. Nazarenko T.A., Durinyan E.R., Baibarina G.V. Hyperandrogenism. A practical guide [Giperandrogeniya. Prakticheskoe rukovodstvo]. M. 2004; 3-5.
12. Reznikov A.G. Praktikuyushchii vrach. 2004; 3: 5.
13. Balen A.H. et al Polycystic ovary syndrome. London and New York. 2005; 256 p.
14. Eckel Robert H. Obesity: mechanisms and clinical management. Philadelphia. 2003; 378-398.
15. Furukawa S., Fujita T., Shimabukuro M. et al. Increased oxidative stress in obesity and its impact on metabolic syndrome. The Journal of Clinical Investigation. 2004; 114 (12): 1752-1761.
16. Kruijver F.P. Zhou J.N., Pool C.W., Hofman M.A., Gooren L.J., Swaab D.F: Male-to-female transsexuals have female neuron numbers in a limbic nucleus. J. Clin. Endocrinol. Metab. 2000; 85: 2034-2041.
17. Swaab D.F: The human hypothalamus. Basic and Clinical Aspects. Part I: Nuclei of the Hypothalamus. Handbook of Clinical Neurology; in Aminoff M.J., Boller F., Swaab D.F. (ed. Amsterdam. 2003; 79.
18. Swaab D.F., Fliers E. A sexually dimorphic nucleus in the human brain. Science. 1985; 228: 1112-1115.
19. Swaab D.F. Sexual differentiation of the human brain: Relevance for gender identity, transsexualism and sexual orientation. Gynecol. Endocrinol. 2004; 19: 301-312.
20. Swaab D.F., Hofman M.A. An enlarged suprachiasmatic nucleus in homosexual men. Brain Res. 1990; 537: 141-148.
21. Swaab D.F. The Human Hypothalamus. Basic and Clinical Aspects. Part II: Neuropathology of the hypothalamus and adjacent brain structures. Handbook of Clinical Neurology. Amsterdam. 2004.
22. Takaya J., Higashino H., Kobayashi Y. Intracellular magnesium and insulin resistance. Magnes. Res. 2004 Jun; 17 (2): 126-36.
23. Zhou J.N., Hofman M.A., Gooren L.J., Swaab D.F. A sex difference in the human brain and its relation to transsexuality. Nature. 1995; 378: 68-70.
The pathogenetic basis for using natural progesterone therapy in obstetric practice
Bitsadze V.O., Akinshina S.V., Khizroeva J.Kh., Makatsariya N.A., Stuleva N.S., Mashkova T.Ya.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Abstract: Progesterone is a natural female hormone. Called “the pregnancy hormone,” it is essential before and during pregnancy. After ovulation occurs, the ovaries start to produce progesterone needed by the uterus. Progesterone causes the uterine lining or endometrium to thicken. This helps prepare a supportive environment in your uterus for a fertilized egg.A supply of progesterone to the endometrium continues to be important during pregnancy. Following a successful implantation, progesterone helps maintain a supportive environment for the developing fetus.
Key words: pregnancy, progesterone, miscarriage. |
|