АНТИФОСФОЛИПИДНЫЕ АНТИТЕЛА, ИХ ПАТОГЕНЕТИЧЕСКОЕ И ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПРИ АКУШЕРСКОЙ ПАТОЛОГИИ
Бицадзе В.О., Хизроева Д.Х., Макацария Н.А., Егорова Е.С., Баймурадова С.М., Машкова Т.Я. Дата публикации на сайте: 2014-08-14 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Антифосфолипидные антитела оказывают многогранное влияние на систему гемостаза, повреждая все его защитные звенья: эндотелиальный барьер, функцию естественных антикоагулянтов, эндогенный фибринолиз и активируя тромбоцитарное звено гемостаза и прокоагулянтные факторы. Сочетание протромботических и нетромботических эффектов, включая активацию локального воспалительного ответа, влияние на трофобласт и характеристики эмбриона, приводят к развитию характерной клинической картины – целому спектру тромботических осложнений в артериальных, венозных сосудах, в системе микроциркуляции по типу ангиопатии, а также к репродуктивным потерям и тяжелым поздним акушерским осложнениям, таким как гестоз и преэкламсия, фетоплацентарная недостаточность, задержка роста плода.
ANTIPHOSPHOLIPID ANTIBODIES, THEIR PATHOGENETIC AND DIAGNOSTIC ISSUES OBSTETRIC PRACTICE Bitsadze V.O., Khizroeva D.Kh., Makatsariya N.A., Egorova E.S., Baymuradova S.M., Mashkova T.Ya.
First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
Abstract: not only thrombotic, but also “non-thrombotic” mechanisms of antiphospholipid antibodies are being actively studied in regard to their impact on the structure of reproductive losses and other complications of pregnancy. Non-thrombotic effects of APA include the damage of cells, the induction of apoptosis, the inhibition of proliferation, the suppression of human chorionic gonadotropin, the interference to the invasion of the trophoblast, and defects of differentiation of the endometrium. Thrombotic effects are: widespread thrombosis, placental infarction, disruption of the annexin barrier, and anti-b2GPI and APC resistance.
Key words: antiphospholipid antibodies, antiphospholipid syndrome, complications of pregnancy, catastrophis antiphospholipid syndrome.
Ключевые слова: антифосфолипидный синдром, антифосфолипидные антитела, осложнения беременности, катастрофический АФС.
ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава РФ, Москва
Исследования в области антифосфолипидного синдрома (АФС) зародились в начале XX века. Под антифосфолипидным синдромом в нас-тоящее время понимают симптомокомплекс, сочетающий определенные клинические признаки и лабораторные данные, – наличие антифосфолипидных антител (АФА) в сочетании с артериальными и венозными тромбозами, синдромом потери плода, иммунной тромбоцитопенией и/или неврологическими расстройствами [1,2].
Исследования в области АФС зародились еще в начале XX в. В 1906 г. Wasserman с коллегами разработали метод серологической диагностики сифилиса, основанный на фиксировании комплемента при взаимодействии аутоантител из сыворотки больных сифилисом и «сифилитического антигена», выделяемого из органов животных. В 1941 г. Pangborn доказал, что химической основой этой реакции является кардиолипин, содержащийся в спиртовом экстракте бычьего сердца и используемый в качестве антигена в реакции Вассермана. Положительные результаты этого теста были обнаружены и у пациентов с аутоиммунными, воспалительными и гематологическими заболеваниями, но без признаков сифилитической инфекции (ложноположительная реакция Вассермана).
В 1965 г. Alarcon-Segovia и Osmundson описали необычную клиническую симптоматику, связанную с периферическими сосудистыми проявлениями СКВ. Сюда входили венозные и артериальные тромбозы, сетчатое ливедо и ложноположительные серологические тесты на сифилис. Эти клинические проявления и сформировали основу антифосфолипидного синдрома, который был окончательно определен Hughes в 1987 г. [9].
В 70-х гг. Feinstein и Rapaport ввели термин «волчаночный антикоагулянт» для обозначения этого неспецифического циркулирующего в плазме ингибитора коагуляции, не связанного с тенденцией к кровотечению и обнаруживаемого преимущественно у пациентов с системной красной волчанкой (СКВ). Впервые связь между тромбозом глубоких вен, привычным невынашиванием и ВА была отмечена Soulier и Boffa в 1980 г. В конце 70-х и начале 80-х гг. было опубликовано много статей с описанием пациентов с подобной клинической симптоматикой, но без клинических и серологических проявлений СКВ. Для обозначения этой новой формы патологии был предложен термин «первичный АФС».
Учитывая то, что АФА обнаруживаются у 2-6% доноров крови (т.е. среди здорового населения) и у 30-40% пациентов с СКВ, проблема АФС является одной из важнейших в медицине [2].
Диагностические критерии АФС
В 1999 г. в Саппоро были предложены диагностические критерии АФС. Однако в дальнейшем появилось много работ, посвященных клиническим и лабораторным проявлениям синдрома, в связи с чем на XI Международном Конгрессе по АФА (2005) сложившиеся в Саппоро критерии диагностики АФС были пересмотрены [13] (см. табл. 1).
Таблица 1. Пересмотренные диагностические критерии АФС (диагноз антифосфолипидного синдрома устанавливается при наличии как минимум одного клинического и одного из лабораторного критерия)1.
Клинические критерии |
1. Сосудистый тромбоз2 | Один и более клинических эпизодов3 артериального, венозного тромбозов или тромбоза мелких сосудов4 в любом органе или ткани. Тромбоз должен быть подтвержден объективными исследованиями. Для гистологического подтверждения тромбоза не должно быть выраженных воспалительных изменений в стенке сосуда |
2. Патология беременности |
а) одна и более необъяснимые смерти морфологически нормального плода (по данным УЗИ или патологоанатомического исследования) в сроках 10 и более нед. беременности;
б) одни и более преждевременные роды до 34 нед. беременности, протекающей с тяжелым гестозом или тяжелой фетоплацентарной недостаточностью5, с рождением морфологически нормального плода;
в) три и более необъяснимых последовательных прерываний беременности в сроках до 10 недель с исключением анатомических и гормональных причин, а также хромосомных аномалий со стороны отца и матери |
Лабораторные критерии6 |
Волчаночный антикоагулянт (ВА) | Обнаруживается в плазме в двух и более случаях с 12-недельным промежутком. ВА определяется в соответствии с рекомендациями субкомитета по ВА Международного Общества по тромбозу и гемостазу фосфолипидзависимых антител. |
Антикардиолипиновые антитела (АКА) | Наличие изотипов IgG и/или IgM в средних или высоких титрах (т.е. более 40 GPL7 или MPL, или более 99 перцентили) в сыворотке или плазме в двух и более случаях, с интервалом не менее 12 нед. Определение АКА должно осуществляться с помощью метода твердофазного иммуноферментного анализа (ELISA). |
Антитела к β2-гликопротеину |
Наличие антител к β2-гликопротеину изотипов IgG и/или IgM (в титрах, превышающих 99 перцентиль) в сыворотке или плазме в двух и более случаях, с интервалом не менее 12 нед. Определение антител должно осуществляться с помощью метода твердофазного иммуноферментного анализа (ELISA). |
1 Диагноз АФС можно снять, если положительные лабораторные тесты и клинические проявления наблюдаются раздельно в течение менее 12 нед. или более 5 лет.
2 Сочетание наследственных или приобретенных факторов риска тромбоза – не повод для исключения пациентов из исследований по АФС. Тем не менее, такие пациенты должны быть разделены на две подгруппы в зависимости от: а) наличия и б) отсутствия дополнительных факторов риска тромбоза. К факторам риска тромбозов относятся: возраст (старше 55 лет для мужчин и старше 65 лет для женщин), наличие любых факторов риска сердечно-сосудистых заболеваний (гипертензия, сахарный диабет, повышение уровня липопротеинов низкой плотности, снижении липопротеинов высокой плотности, курение, отягощенный семейный анамнез в отношении сердечно-сосудистых заболеваний, индекс массы тела >30 кг/м2, микроальбуминурия, скорость клубочковой фильтрации – менее 60 мл/мин), генетическая тромбофилия, прием оральных контрацептивов, нефротический синдром, злокачественные заболевания, длительная иммобилизация, хирургические вмешательства.
3 Тромботический эпизод в анамнезе может считаться клиническим критерием, при условии, что тромбоз подтвержден соответствующими диагностическими методами и при отсутствии других причин тромбоза.
4 Поверхностные венозные тромбозы не включены в клинические критерии.
5 Общепринятые признаки плацентарной недостаточности включают в себя: 1) ареактивный нестрессовый тест при кардиомониторировании плода, свидетельствующий о гипоксии плода; 2) нарушения кровотока, выявляемые при допплерографии – отсутствие конечного диастолического кровотока в пупочной артерии – также свидетельствует о гипоксии плода; 3) маловодие, т.е. индекс амниотической жидкости <5 см; 4) масса плода при рождении, составляющая менее 10 перцентили для данного гестационного возраста.
6 Исследователи настоятельно рекомендуют классифицировать пациентов с АФС согласно следующим категориям:I – наличие более одного лабораторного критерия (любая комбинация), IIа – наличие только ВА, IIb – наличие только АКА, IIс – наличие только антител к b2-гликопротеину.
7 Один mpl эквивалентен 1 мг IgG. Общепринято результаты анализа оценивать как «высокопозитивные» (более 60 mpl ЕД/мл или более 80 GPL), «среднепозитивные» (20-80 GPL или 20-60 mpl ЕД/мл) или «низкопозитивные» (менее 20 GPL или mpl ЕД/мл). Результаты менее 10 GPL или mpl ЕД/мл рассматриваются как отрицательные.
Следует отметить, что комиссия по АФА выступает против использования термина «вторичный» АФС. Это связано с тем, что большинство пациентов с так называемым «вторичным» АФС страдают СКВ. Неясно, являются ли АФС и СКВ двумя отдельными заболеваниями, присутствующими у одного и того же пациента, или СКВ является фоном для развития АФС, или же АФС и СКВ представляют собой два элемента одного и того же процесса. Таким образом, взаимосвязь между СКВ, АФС и волчаночно-подобным синдромом требует дальнейших исследований. По мнению исследователей, более важным является диагностика сопутствующей СКВ (или другого завоевания), а не разделение АФС на «первичный» и «вторичный».
Классификации АФС
Большинство исследователей все же выделяют первичный и вторичный АФС. О первичном АФС говорят при наличии клинических признаков заболевания и отсутствии симптомов различных заболеваний соединительной ткани, включая СКВ, ревматоидный артрит, аутоиммунную тромбоцитопеническую пур-пу-ру. АФС на фоне заболеваний соединительной ткани, различных аутоиммунных заболеваний, злокачественных опухолей, инфекционно и лекарственно-обусловленный считается вторичным АФС.
Классификация АФС представлена в таблице 2. Критерии дифференциальной диагностики первичного АФС и АФС на фоне СКВ представлены в таблице 3 [15]. Наличие любого из перечисленных критериев исключает диагноз первичного АФС. Для исключения СКВ необходимо наблюдение в течение 5 лет и более после манифестации первых клинических проявлений.
Таблица 2. Классификация АФС.
I. Первичный АФС |
II. Вторичный АФС
А. На фоне аутоиммунных заболеваний
1) Системных:
– системной красной волчанки
– ревматоидного артрита
– синдрома Шегрена
– системной склеродермии
– васкулитов:
узелкового полиартериита
гигантскоклеточного артериита/ревматической полимиалгии
артериита Такаясу
болезни Бехчета
– Недифференцируемых заболеваний соединительной ткани
2) Органоспецифичных:
– сахарного диабета
– болезни Крона
Б) На фоне злокачественных опухолей
1) Солидных:
– тимома
– карцинома (легких, почек, яичников, шейки матки, предстательной железы)
2) Гематологических:
– лимфома
– лейкемия
– макроглобулинемия Вальденстрема
– миелопролиферативные заболевания
В) Лекарственноиндуцированный АФС
– фенотиазины
– прокаинамид
– хлоротиазид
– этосуксимид
– оральные контрацептивы
– альфаИнтерферон
– фенитоин
– хинин, хинидин
– гидралазин
Г) Инфекционно-опосредованный АФС
– сифилис
– ВИЧ
– малярия
Д) На фоне других состояний
– конечная стадия почечной недостаточности |
III. Другие варианты АФС
А) Серонегативный АФС
Б) Катастрофический АФС
В) Тромботический шторм
Г) Полиорганная недостаточность
Д) Другие микроангиопатические синдромы
– тромботическая тромбоцитопеническая пурпура – гемолитико-уремический синдром
– HELLP-синдром
Е) ДВС-синдром
Ж) Синдром волчаночный антикоагулянт-опосредованной гипопротромбинемии |
Катастрофический антифосфолипидный синдром (КАФС) является наиболее тяжелой формой антифосфолипидного синдрома. Он проявляется множественными тромбозами жизненно важных органов и развитием полиорганной недостаточности на фоне высокого титра антифосфолипидных антител. Этот синдром носит имя синдрома Ашерсона, который в 1992 г. впервые ввел в клиническую практику термин КАФС [2,19]. Хотя КАФС развивается менее чем у 1% из всех пациентов с АФС, он является угрожающим жизни состоянием и требует неотложной терапии. Несмотря на лечение, летальность при КАФС достигает 50%. Сегодня КАФС рассматривается с позиций синдрома системного воспалительного ответа (ССВО) и характеризуется развитием системной эндотелиальной дисфункции, системным выбросом провоспалительных цитокинов, активацией процессов коагуляции и формированием ДВС-синдрома. Под влиянием антифосфолипидных антител происходит формирование прокоагулянтного и провоспалительного потенциала, на фоне которого под действием дополнительных провоцирующих факторов (инфекция, травма, хирургическое вмешательство, прием оральных контрацептивов) развивается КАФС, то есть реализуется декомпенсация системы гемостаза, запускается системный воспалительный ответ и формируется полиорганная недостаточность.
Таблица 3. Критерии для дифференциальной диагностики первичного АФС и АФС на фоне СКВ [9].
Сыпь на щеках
Дискоидная сыпь
Язвы полости рта и ротоглотки, за исключением изъязвления и перфорации носовой перегородки
Выраженный артрит
Плеврит при отсутствии признаков эмболии легочной артерии или левожелудочковой сердечной недостаточности
Перикардит при отсутствии признаков инфаркта миокарда или уремии
Персистирующая протеинурия более 0,5 г/сут. в результате гистологических подтвержденного иммунокомплексного гломерулонефрита
Лимфопения менее 1,000/мкл
Антитела к нативной ДНК, выявленные методом радиоиммунного анализа или Crithidia флюоресценцией
Титр антиядерных антител более 1:320
Лечение лекарственными препаратами, часто способствующими образованию АФА
|
Клинические проявления АФС
Антифосфолпидный синдром по праву называют синдромомхамелеоном. При участии различных молекулярных механизмов и взаимодействий развивается целый спектр клинических проявлений.
Антифосфолипидный синдром является системным заболеванием и может проявляться одним или одновременно несколькими клиническими признаками со стороны различных систем органов – вплоть до развития так называемой катастрофической формы АФС, характеризующейся острой полиорганной недостаточностью, напоминающей таковую при ДВС-синдроме с развитием острого респираторного дистресс-синдрома, поражением ЦНС (инсульт, ступор, дезориентация), инфарктами миокарда и гастроинтестинальных органов, надпочечниковой недостаточностью и пр. Учитывая, что АФС занимает первое место среди причин тромбозов, эпизоды тромбозов на фоне приема оральных контрацептивов, в послеоперационном периоде, при иммобилизации и других предрасполагающих факторах, а также рецидивирующие тромбозы и тромбоэмболии или множественность мест поражения должны насторожить врачаклинициста в отношении возможного наличия АФС. Не менее ярким проявлением АФС являются неудачи, связанные с терапией непрямыми антикоагулянтами после тромбоза, которые проявляются ретромбозами.
Основные клинические проявления АФС перечислены в таблице 4.
Таблица 4. Основные клинические проявления АФС.
ЦНС
Хорея
Мигрень
Психоз
Эпилепсия
Транзиторные ишемические атаки/инсульты
Гипоперфузия
Нейросенсорная потеря слуха
Поперечная миелопатия
Когнитивные расстройства
Псевдоопухоль мозга
Тромбозы церебральных вен/артерий
Тромбозы сосудов сетчатки
Синдром подобный рассеянному склерозу
Гастроинтестинальные
Печеночный некроз
Некалькулезный холецистит
Синдром Бадда-Киари (тромбоз печеночных вен)
Интестинальная ишемия
Сосудистые
Атеросклероз
Болезни клапанов сердца
Острый инфаркт миокарда
Неудачные результаты ангиопластики
Диастолические нарушения. Внутрисердечный тромбоз
Кардиомиопатия
Болезнь Бюргера (облитерирующий тромбоангиит)
Кожные
Сетчатое ливедо (Livedo reticularis)
Кожные изъязвления
Подногтевые геморрагии
Поверхностные тромбофлебиты
Дистальная кожная ишемия (акроцианоз)
Гангреноподобные повреждения кожи
Некроз кожи
Костные
Аваскулярный остеонекроз
Некроз костного мозга
Почечные
Гломерулярный тромбоз
Стеноз почечной артерии
Почечная недостаточность
Тромбоз почечной вены/артерии
Легочные
Легочный эмболизм
Легочная гипертензия
Острый респираторный дистресс-синдром (ОРДС)
Эндокринные
Надпочечниковая недостаточность
Гипопитуитаризм
Гематологические
Тромбоцитопения
Аутоиммунная гемолитическая анемия
Лейкопения
Акушерские
Привычное невынашивание
Гестозы
Внутриутробная задержка развития плода
HELLP-синдром
Неудачные попытки ЭКО и искусственного осеменения
Послеродовый плевропульмональный синдром
Катастрофический АФС
Мультиорганная недостаточность |
Далее более подробно обсуждаются последствия АФС, имеющие наиболее важное клиническое значение.
Большинство исследований по типу случай-контроль, проведенные среди пожилых людей, обнаружили прямую взаимосвязь циркуляции АФА с развитием ишемического инсульта. Было обнаружено повышение титра АФА в крови пациентов через 7 дней и даже через 6 ч после тромбоза, хотя этого времени недостаточно для нарастания титра антител. Средний возраст АФА – ассоциированной церебральной ишемии – на несколько десятков лет меньше возраста типичной церебральной ишемической в популяции. Нет данных о том, влияет ли тяжесть тромбоэмболических осложнений на титр антикардиолипиновых антител [6].
Недавно было завершено первое проспективное исследование, касающееся роли АФА в развитии повторных ишемических инсультов (APASS) [1]. Оно было начато в 1993 г. и оценивало риск рецидива инсультов и других тромбоэмболических осложнений в течение двух лет у пациентов, перенесших ишемический инсульт и получавших в качестве терапии либо аспирин (325 мг в сут.), либо варфарин (МНО=2,2). Результаты исследования свидетельствуют об одинаковой эффективности терапии аспирином и варфарином у пациентов с АФА, перенесших ишемический инсульт. В исследовании не использовались более высокие дозы варфарина с большим значением MHO, хотя, возможно, они были бы более эффективны для профилактики рецидивов АФА-ассоциированных инсультов.
Когнитивные нарушения при АФС могут варьировать от легких расстройств до сосудистой деменции. Хотя специфическая роль антифосфолипидных антител остается неясной, тем не менее, очевидно, что большинство когнитивных нарушений при АФС являются результатом тромбоза.
Применение доплеровской эхокардиографии позволило выявить высокую частоту патологии сердечных клапанов у пациентов, страдающих СКВ с циркуляцией АФА, по сравнению с больными СКВ без циркуляции АФА. Почти у 89% больных с СКВ и заболеваниями клапанов сердца были обнаружены АФА, по сравнению с 44% больных без поражений клапанов. Эхокардиографические исследования обнаружили патологию сердечных клапанов почти у одной трети больных первичным АФС. Основными изменениями были утолщение клапанов, вегетации и клапанная регургитация.
Случаи инфаркта миокарда в группе женщин в возрасте от 35 до 44 лет, страдающих СКВ, развиваются в 50 раз чаще, по сравнению с контрольной группой. Инфаркт миокарда при СКВ обычно связан с атеросклерозом, возникающем в результате длительного приема стероидов, гиперлипидемии, гипертензии и васкулита. К этим классическим механизмам следует добавить циркуляцию антифосфолипидных антител как возможный фактор развития инфаркта миокарда. Наличие высокого титра антикардиолипиновых антител в настоящее время признается в качестве независимого фактора риска инфаркта миокарда. Выявлена корреляция между уровнем антикардиолипиновых антител и антител к окисленным липопротеинам низкой плотности (ЛПНП). Возможно, этот механизм является ответственным за развитие эндотелиальной дисфункции и прогрессирование атеросклероза.
Обязательный скрининг на антифосфолипидные антитела у пациентов с инфарктом миокарда должен быть выполнен в следующих случаях: 1) если пациент моложе 45 лет; 2) если в анамнезе имеются случаи венозного или артериального тромбоза или привычного невынашивания; 3) у пациентов с отягощенным семейным анамнезом в отношении аутоиммунных заболеваний, особенно СКВ; 4) при наличии окклюзии вен трансплантата, наступившей ранее чем через год после операции или окклюзии, несмотря на терапию варфарином или аспирином; 5) при реокклюзии артерий после успешно проведенной ангиопластики или реокклюзии, несмотря на терапию варфарином или аспирином.
Эмболия легочных сосудов и инфаркт легкого являются наиболее частыми легочными проявлениями АФС (встречаются у 17-33%) и могут быль первым проявлением заболевания. Высокая частота подобных проявлений объясняется частыми рецидивирующими тромбозами глубоких вен у пациентов с АФС, что приблизительно в трети случаев осложняется эмболией в легочные сосуды и инфарктом легкого. Другими источниками тромбоэмболии могут быть также нижняя полая вена и почечная артерия, вегетации трикуспидального клапана, а также правосторонние внутрисердечные тромбы. Последнее обстоятельство требует систематического проведения эхокардиографии у больных с АФС и легочным эмболизмом. Наличие высоких титров АКА или ВА у пациентов с «идиопатическим» венозным тромбоэмболизмом значительно повышает риск рецидивирующих тромбозов и тромбоэмболий. Легочный эмболизм является ведущей причиной легочной гипертензии у пациентов с АФС.
Сетчатое ливедо (livedo reticularis) является наиболее частым кожным проявлением АФС (встречается приблизительно у 25% пациентов с АФС) и представляет собой необычное проявление стаза в кожных сосудах, характеризующееся отдельными участками цианоза. Сетчатый характер ливедо соответствует области анастомозов между двумя конусами артериолярных ветвей, за счет которых в норме происходит кровоснабжение кожи. Эти кожные проявления часто сочетаются с рецидивирующими артериальными и венозными тромбозами, патологией клапанов и цереброваскулярными тромбозами с сопутствующей эссенциальной гипертензией (синдром Снеддона).
Почки являются одними из основных органовмишеней для АФА, что, по-видимому, связано с тем, что почки, как и мозг, чрезвычайно богаты фосфолипидами. Тромбоз сосудов почек, обусловленный АФА, может приводить к различным клиническим проявлениям: системной гипертензии различной степени тяжести, протеинурии, гематурии, тромботической микроангиопатии, в т.ч. ассоциированной с беременностью, прогрессирующей почечной недостаточности, требующей проведения гемодиализа.
У пациентов с АФС описано развитие тяжелой или злокачественной гипертензии в отсутствие пролиферативного гломерулонефрита. Гистологически наблюдались ишемия гломерул, внутрипочечные артериальные или артериолярные тромботические поражения или фиброз интимы. Схожие поражения были описаны при нефропатии у беременных. Гистологическое исследование показало наличие фибриновых тромбов в гломерулярных капиллярах, артериолах и междолевых артериях. Электронное микроскопическое исследование подтвердило наличие тромботической микроангиопатии.
Наиболее характерным проявлением АФС служит акушерская патология: привычное невынашивание, неудачи экстракорпорального оплодотворения (ЭКО), гестозы, включая преэклампсию и эклампсию, плацентарная недостаточность, внутриутробная задержка роста плода, преждевременная отслойка нормально расположенной плаценты (ПОНРП).
В последние годы в мировой литературе и медицинской практике для обозначения репродуктивных потерь активно используется термин «синдром потери плода», который является более широким понятием и включает в себя:
– один или более самопроизвольных выкидышей на сроке 10 нед. и более (включая неразвивающуюся беременность);
– мертворождение;
– неонатальная смерть, как осложнение преждевременных родов, тяжелого гестоза или плацентарной недостаточности;
– три или более самопроизвольных выкидышей на преэмбрионической или ранней эмбрионической стадии, когда исключены анатомические, генетические и гормональные причины невынашивания.
Частота синдрома потери плода при АФС достигает 50-75% [8,9]. Прерывание беременности может иметь место в любые сроки беременности, и выкидыш зачастую остается единственным симптомом у пациентов с первичным АФС. Для АФС характерен любой тип синдрома потери плода, включая предимплантационные потери.
Тромботический шторм и антифосфолипидный синдром
После открытия катастрофического антифосфолипидного синдрома R.A. Asherson началась эра активного изучения этой наиболее тяжелой формы АФС. С современных позиций в понятие КАФС включают [19]: развитие множественных тромбозов за короткий период времени (менее одной недели), развитие полиорганной недостаточности, тромбозы в мелких сосудах, развитие ССВО, высокий риск атипичных тромбозов (костного мозга, органов репродуктивной системы), лабораторные признаки АФС. Рассматривая КАФС с позиций синдрома системного ответа на воспаление, становится понятным колоссальное сходство клинических проявлений КАФС и сепсиса. Развивающийся синдром системного ответа на воспаление приводит к формированию распространенной тромботической васкулопатии, что, в свою очередь, объясняет широкий спектр клинических проявлений КАФС, обусловленных повреждением тканей и развитием полиорганной недостаточности, включая нарушение функции почек, ОРДС, развитие церебральных нарушений («острый церебральный дистресс-синдром»), снижение сократительной активности миокарда и развитие катехоламинрефрактерной гипотензии. Таким образом, ССВО не оставляет организму шансов, поражая все защитные механизмы, обусловливая блокаду микроциркуляторного русла и развитие мультиорганной недостаточности.
В последнее время все больше внимания уделяется изучению роли КАФС в патогенезе акушерских осложнений. Такие типично акушерские осложнения как эклампсия, HELLP-синдром, преждевременная отслойка нормально расположенной плаценты могут быть проявлениями КАФС. Таким образом, КАФС является гораздо более распространенным явлением, нежели было принято считать до сих пор. Кроме того, эклампсия, HELLP-синдром, ПОНРП могут развиваться и при наличии других дефектов гемостаза, в частности, при мутации FV Leiden и дефиците PS. Сочетание приобретенной тромбофилии, обусловленной АФС, с генетическими дефектами гемостаза существенно усугубляет течение патологического процесса и приводит к развитию тромботических осложнений. Возможно, сочетание наследственных тромбофилий и АФС создает благоприятный фон, при котором при определенных условиях возможна декомпенсация системы гемостаза и развитие КАФС.
КАФС характеризуется мультиорганным поражением и вовлечением всех органов и систем с развитием полиорганной недостаточности. Во время беременности появляется новый чрезвычайно важный как для матери, так и для плода орган – плацента. Морфолигически множественные микротромбозы и инфаркты плаценты выявляются при многих акушерских осложнениях, включая гестозы, HELLP-синдром, ДВС-синдром, обусловленный различными причинами, в т.ч. и акушерскими кровотечениями и септическими осложнениями. На сегодняшний день значение генетических форм тромбофилии и АФС в патогенезе акушерских осложнений является общепризнанным, более того, акушерские осложнения являются одним из диагностических критериев АФС. В связи с этим у пациенток с акушерскими осложнениями крайне важно провести исследование на наличие АФА. Это поможет вовремя распознать КАФС, своевременно начать терапию и избежать прогрессирования этого потенциально летального осложнения.
Интересно, что впервые ДВС-синдром был описан McKay (1965) у 38-летней женщины с СКВ. Данные анамнеза этой больной (наличие хореи, поражение митрального клапана, привычное невынашивание беременности) свидетельствуют в пользу вторичного АФС. Через несколько дней после холецистэктомии у женщины развились признаки мультиорганной не-достаточности (почечная, сердечная недостаточность, ОРДС, лихорадка) в сочетании с низким уровнем фибриногена, тромбоцитопенией и увеличением ПВ (по лабораторным данным). Полиорганная недостаточность стала причиной летального исхода через неделю после оперативного вмешательства. При патологоанатомическом исследовании обнаружились типичные для КАФС проявления тромбоза микрососудистого русла. Таким образом, McKay наблюдал развитие КАФС и одновременно синдром ДВС, однако в то время о существовании КАФС не было известно.
Одной из самых больших загадок КАФС является развитие микротромбозов, тогда как для классического АФС характерны в основном макротромбозы. Согласно Kitchens C.S. (1998), массивное тромбообразование влечет за собой прогрессирование тромбоза, которое автор назвал «тромботическим штормом» [11,14]. В основе этого явления лежит прогрессирующая активация образования тромбина, угнетение фибринолиза за счет PAI-1, потребление антикоагулянтных факторов: PC, PS, AT III, развитие массивного тканевого повреждения, выброса цитокинов, развитие ДВС-синдрома, системного ответа на воспаление и полиорганной недостаточности (см. рис. 1).
![Рисунок 1: Гипотеза «тромботического шторма» [11].](http://gyn.su/img/AGR_2014-2_b1s.jpg) | Рисунок 1: Гипотеза «тромботического шторма» [11]. |
Мы считаем, что признаки ДВС-синдрома могут развиваться практически во всех случаях КАФС, что обусловлено общими патогенетическими механизмами этих состояний. Так, в основе КАФС и ДВС-синдрома лежит универсальный патологический процесс – синдром системного воспалительного ответа. При КАФС и при ДВС-синдроме выявляются сходные провоцирующие факторы (инфекция, травма, беременность), наблюдается развитие эндотелиальной дисфункции, выброс провоспалительных цитокинов и активация коагуляции.
Совсем недавно был описан феномен тромботического шторма, который по аналогии с КАФС характеризуется множественными тромбозами, развивающимися в течение короткого периода времени. Однако при этом известные в настоящее время формы тромбофилии выявляются не всегда [14].
Критерии диагностики такого варианта тромботического шторма включают:
– два или более эпизодов венозных/артериальных тромбоза/микроангиопатии;
– атипичную локализацию тромбозов;
– рефрактерность тромбозов к стандартной терапии.
При этом наиболее частым триггером тромботического шторма является беременность. Согласно нашей концепции причиной возникновения этого состояния служат тяжелые формы мультигенной тромбофилии (две и более гомозиготные формы высокотромбогенных мутаций) одновременно с повышенными уровнями кофакторов. Для своевременной диагностики необходимо исследовать уровень АФА у всех пациентов с ДВС-синдромом, особенно у пациентов, у которых тромбозы развиваются при отсутствии явного провоцирующего фактора, при рецидивирующих тромбозах, при тромботических осложнениях во время беременности, включая тяжелую акушерскую патологию, в т.ч. при преэклампсии, антенатальной гибели плода, подозрении на эмболию околоплодными водами.
Патогенез АФС
Патогенез тромбозов при АФС еще недостаточно изучен, поскольку АФА сами по себе столь гетерогенны, что и механизмы их участия в патогенезе тромбофилического состояния могут быть различными. АФА нарушают баланс системы гемостаза, влияя на различные его ступени: активируя коагуляцию и тромбоцитарное звено, блокируя фибринолиз и антикоагулянтную систему, вызывая эндотелиальную дисфункцию и активируя процессы воспаления.
Антифосфолипидные антитела представляют собой семейство гетерогенных ауто- и аллоиммунных иммуноглобулинов: IgG, IgM и IgA [18].
Виды АФА:
1. Волчаночный антикоагулянт.
2. Антикардиолипины.
3. Антитела к анионным фосфолипидам:
- антифосфатидилсерин;
- антитела к фосфатидной кислоте;
- антифосфатидилинозитол;
- атнифосфатидилглицерол.
4. Антитела к нейтральным фосфолипидам, антифосфатидилэтаноламин.
Использование высокочувствительных тестов демонстрирует наличие антител к вышеупомянутым фосфолипидам у значительной части здоровых людей. Можно предположить, что наличие АФА является универсальным ответом организма на различные клинические состояния, которые обусловлены инфекцией, аутоиммунными, злокачественными заболеваниями, медикаментозными воздействиями, а также воздействием экологических факторов (аллергенные, радиационные и пр.). Отмечено, что у многих людей наличие АФА носит транзиторный характер и не проявляется клинически.
Разнообразие АФА очень велико; кроме того, в последнее время были открыты антитела к новым кофакторам, клиническое значение которых еще предстоит установить. В то же время клиническое и диагностическое значение других классов антител оспаривается, как в случае с антикардиолипинами [18] (см. рис. 2).
 | Рисунок 2: Многообразие антифосфолипидных антител и их клиническое значение. |
Фосфоглицериды являются основным составным компонентом клеточных мембран, они в значительной концентрации определяются в железистых тканях, плазме, желточном мешке и других тканях. Они составляют до 40% липидов мембран эритроцитов и более 95% липидов внутренней мембраны митохондрий. Для всех фосфоглицеридов характерно, что одна часть их молекулы резко гидрофобна, а другая гидрофильна, что позволяет им находиться на грани раздела водной и неводной фаз. Существует несколько подклассов фосфоглицеридов.
Чаще всего в организме животных и высших растений встречаются «нейтральные фосфолипиды» – фосфатидилхолины и фосфатидилэтаноламины.
Кардиолипин (дифосфатидилглицерол) является двойным фосфолипидом, присутствует на внутренней поверхности митохондрий, где составляет до 20% от всех липидов. Свободная фосфатидная кислота встречается в относительно небольших количествах по сравнению с другими ФЛ.
Фосфатидилсерины (ФС) и фосфатидилинозитолы (ФИ) относятся к группе «отрицательно заряженных» (анионных) ФЛ. В составе полярной «головки» они соответственно содержат отрицательно заряженные остатки аминокислоты серина и циклического спирта инозитола.
Фосфатидилинозитол найден в мозге, легких, печени. Фосфатидилсерины (ФС) распространены менее широко, но именно им отводится одна из основных ролей в реализации патологического аутоиммунитета при АФС. ФС располагается во внутреннем слое плазматической мембраны клетки. Такое расположение обеспечивается ферментом аминофосфолипидтранслоказой (флиппазой). Нормальные мембраны клеток имеют четкую фосфолипидную асимметрию. Внешний слой богат холинфосфолипидами, тогда как внутренний – аминофосфолипидами. Перемещение большого количества ФС в наружный слой мембраны возникает очень редко и имеет важное значение. Так, экстернализация ФС происходит в стареющих эритроцитах, это позволяет макрофагам распознать их и фагоцитировать. Лимфоциты и другие клетки, подвергающиеся апоптозу, также экстернализируют ФС, которые являются опознавательным местом при удалении клеток. На миобластах при формировании миотубул увеличивается количество ФС на поверхности. Этот процесс предшествует межклеточному слиянию миобластов. Тромбоциты при активации экспонируют ФС, создавая матрицу для активизации протромбиназы и реакций свертывания. Во всех случаях ФС экспонируются на поверхности клеточных мембран клеток, которые подлежат разрушению, либо реинтернализация происходит очень быстро.
С использованием моноклональных АТ к ФЛ было показано, что трофобласт при дифференциации и инвазии в экстрацеллюлярный матрикс также экспонирует ФС. Так как слияние клеток и рост синцития продолжается почти всю беременность, клетки трофобласта, возможно, являются единственными клетками в организме человека, столь длительно экспонирующими на своей поверхности отрицательно заряженные ФЛ.
В 90-х годах было показано, что причиной тромбозов при АФС является не прямое взаимодействие АФА с отрицательно заряженными или нейтральными фосфолипидами, как считалось ранее, а белокопосредованное. В качестве таких белков-кофакторов чаще всего выступает белок плазмы крови: β2-гликопротеин I (β2-GPI), который, связываясь с фосфолипидами, образует истинный антиген для АФА, а также протромбин.
Помимо β2-GPI и протромбина имеется еще множество белков-кофакторов, являющихся мишенями для АФА (см. табл. 5).
Таблица 5. Антигенные мишени для антифосфолипидных антител: фосфолипид-связывающие протеины.
| Основные антигены | Другие антигены |
|---|
β2-GPI
Протромбин | Протеин С
Протеин S
Тканевой активатор плазминогена (t-PA)
Аннексины
Тромбомодулин
Окисленные липопротеины низкой плотности
Фактор XII
Фактор Х
Фактор XI
Фактор VII/VIIa
Прекалликреин
Высоко и низкомолекулярный кининоген
H и C4b компоненты комплемента
Эндотелиальный рецептор протеина С (ЕРCR) |
В ряде случаев возможно и прямое взаимодействие АФА с фосфолипидами, что чаще имеет место при инфекции. При этом АФА представлены IgM.
Феномен волчаночного антикоагулянта. В 1972 г. Feinstein и Rapaport ввели термин «волчаночный антикоагулянт» для обозначения неспецифического циркулирующего в плазме ингибитора коагуляции, не связанного с тенденцией к кровотечению и впервые обнаруженного у пациентов с СКВ. С современных позиций в основе феномена ВА лежит циркуляция антител к β2-GPI классов IgG или IgM и антипротромбиновых антител. Антитела, связываясь с антифосфолипидными поверхностями, препятствуют взаимодействию фосфолипидов с факторами коагуляции, что приводит к нарушению формирования протромбиназного комплекса и образования тромбина. В результате in vitro наблюдается удлинение свертывания крови (удлинение АЧТВ, теста с ядом гадюки Рассела [dRVVT]). Тем не менее, in vivo наблюдается не склонность к кровотечениям, а наоборот, развивается протромботическое состояние. Механизм развития акушерских и тромботических осложнений у пациентов с ВА до конца не ясен. Предполагается, что антифосфолипидные антитела являются причиной развития резистентности к активированному протеину С, подавляет активность протеинов С и S, связывает необходимый для активации протеина С тромбомодулин, нарушает функцию ингибитора тканевого фактора ингибитора тканевого фактора (TFPI). Все это приводит к нарушению функции естественных антикоагулянтов и смешению равновесия в системе гемостаза в сторону протромботического состояния (см. рис. 3).
 | Рисунок 3: Антитела к протромбину и β2-гликопротеину I нарушают формирование протромбиназного комплекс.
Этот механизм лежит в основе феномена волчаночного антикоагулянта. Антитифосфолипидные антитела обуславливают формирование резистентности к активированному протеину С (АРС) за счет нескольких механизмов: нарушение образования тромбина – активатора протеина С (тромбиновый парадокс), инактивация протеинов С и S, нарушение функции тромбомодулина (антитела к тромбомодулину), нарушение сборки АРС на анионной фосфолипидной поверхности. |
Особенно следует отметить, что определение АЧТВ мало пригодно для определения феномена ВА. На сегодняшний день, согласно последним рекомендациям по диагностике АФС, лучшим методом для выявления ВА является тест с ядом гадюки Рассела (dRVVT) [13].
β2GP1 и антитела к β2GP1. β2GP1 впервые был описан в 1961 г. Schultze. При изучении его физиологической роли была обнаружена способность гликопротеида связываться с отрицательно заряженными участками макромолекул: липопротеинов, тромбоцитов, митохондрий, гепарина (или гепарансульфата). Как известно, отрицательно заряженные макромолекулы способны запускать внутренний путь свертывания крови, в связи с чем было высказано предположение о роли β2GP1 как физиологического нейтрализатора коагуляции. Кроме того, β2GP1 ингибирует АДФ-зависимую агрегацию тромбоцитов. Позже было обнаружено, что β2GP1 является составной частью хиломикронов, липопротеинов очень низкой и высокой плотности, обнаружена его роль в метаболизме липидов (активация липопротеинлипазы). В 1968 г. были описаны случаи недостаточности β2-GP1, которые никак не проявлялись клинически. Таким образом, биологическая роль данного плазменного протеина оставалась до конца не выясненной. С 1990 г. в связи с открытием β2-GP1 как кофактора для АФА, он вновь стал активно изучаться.
В 1990 Galli и соавт. сообщили, что очищенные антитела с антикардиолипиновой активностью связываются с фосфатидилсерином или кардиолипином, а также с липосомами, содержащими эти фосфолипиды, только в присутствии плазменного кофактора, который и был идентифицирован как β2GP1. Характерно, что у больных с сифилисом кофактор для связывания АФА с этими фосфолипидами не требовался.
Хотя в физиологических условиях β2-GP1 связывается с анионными фосфолипидными мембранами довольно слабо, при наличии анти-β2GP1-антител образуется комплекс перекрестно связанных β2GP1 и антител, который может обладать высокой способностью связываться с фосфолипидной мембраной (см. рис. 4). Эта высокая способность к связыванию может следовать из факта о том, что в комплексе перекрестно связанных β2GP1 и соответствующих антител содержится 2 и более β2-GP1 молекул, би- и мультивалентно связанных с фосфолипидной мембраной. При образовании таких комплексов аффинность β2-GP1 к фософлипидам увеличивается более чем в 100 раз. Тогда как мономерный β2-GP1 в физиологических концентрациях не способен эффективно конкурировать с факторами коагуляции или другими фосфолипид-связывающими протеинами (типа аннексина V) за анионные мембранные поверхности, комплекс β2-GP1-антитело может конкурировать весьма успешно. Эти комплексы уменьшают количество анионных фосфолипидных поверхностей, необходимых для образования протромбиназного комплекса in vitro, и, тем самым, демонстрируют эффект ингибирования фосфолипид-зависимых коагуляционных реакций in vitro.
 | Рисунок 4: Механизм связывания анти-β2-гликопротеин I с фосфолипидным слоем. |
Существует также предположение, что анти-β2GP1-антитела направлены исключительно против конформационных эпитопов, экспрессированных на β2GP1 только тогда, когда последний связан с анионной фосфолипидной мембраной или другой отрицательно заряженной поверхностью.
Последние исследования показали, что рецепторами для связывания комплексов β2GP1-антитело к β2-GP1 могут быть аннексин V, на эндотелиальных клетках и моноцитах и апоER на тромбоцитах. Открытие того факта, что апоER может функционировать как рецептор к комплексам β2-GP1-антитело к β2-GP1, позволяет объяснить некоторые нетромботические проявления АФС. АпоER относится к семейству рецепторов ЛПНП. Было обнаружено, что большинство, если не все рецепторы этого семейства, способны играть роль рецепторов к комплексу β2-GP1-антитело к β2-GP1. Различные типы рецепторов семейства рецепторов ЛПНП присутствуют практически на всех клетках. Таким образом, взаимодействие комплекса β2GP1-антитело к β2-GP1 с ними приводит к эффектам, специфичным именно для данного типа клеток. Возможно, именно этим взаимодействием можно объяснить нетромботические эффекты АФА, например, связанные с воздействием на нейроны и другие клетки, что требует дальнейшего изучения. Существует предположение, что такое взаимодействие с АпоER приводит к смещению баланса гемостаза в строну состояния гиперкоагуляции. У пациентов с циркуляцией антител к β2GP1 наблюдается фосфорилирование рецепторов АпоER, фосфорилирование MAPp38, что приводит к активации синтеза тромбоксана А2.
Активно изучается клиническое значение анти-β2-GP1. Антиβ2-GP1 являются более специфичными, чем антикардиолипины, в отношении развития тромбозов. В клинических исследованиях установлена важная роль анти-β2-GP1 в патогенезе артериальных тромбозов (инфаркта миокарда, инсульта). Подобные результаты стали стимулом к изучению роли анти-β2-GP1 в патогенезе атеросклероза и атеротромбоза. Предполагается, что анти-β2-GP1 обладают способностью связываться с окисленными ЛПНП (оЛПНП). Подобное взаимодействие может иметь физиологическое значение: β2GP1, связывая высокоатерогенные, нестабильные ЛПНП, обладающие высоким провоспалительным потенциалом, способствуя ускорению клиренса частиц окисленных липопротеинов. Однако в условиях постоянной активации оксидативного стресса, которая наблюдается при СКВ и АФС, этот механизм может потерять физиологическое значение и стать проатерогенным. Антитела к комплексу β2GP1-оЛПНП взаимодействуют с Fcg-рецепторами макрофагов и стимулируют накопление липидов в макрофагах и образование атеросклеротической бляшки. Интересно, что у пациентов с АФС и с артериальными тромбозами в анамнезе анти-β2GP1 к оЛПНП выявляются значительно чаще (в 38%), чем у пациентов с АФС с венозными тромбозами в анамнезе. В последнее время в патогенезе тромботических осложнений при АФС выявлена роль анти-β2GP1 не только классов IgG и IgM, но и класса IgA [4]. Таким образом, у пациентов с подозрением на АФС при отсутствии ВА, антикардиолипинов, анти-β2GP1 классов IgG и IgM целесообразно определение анти-β2GP1 класса IgА (см. рис. 5).
 | Рисунок 5: Патогенетическое значение бета 2-гликопротеина I.
В условиях АФС в присутствии антител к бета 2-гликопротеину I происходит увеличение его афинности к отрицательно заряженным фосфолипидам более чем в 100 раз. В результате его баланс антикоагулянтной активности β 2-GPI смешается в пользу протромботической функции комплексов АФА с β 2-GPI, что приводит к ингибированию пути протеина С,активации коагуляции в следствие увеличения экспрессии тканевого фактора и усиления адгезивной способности тромбоцитов. |
В условиях АФС в присутствии антител к бета2-гликопротеину I происходит увеличение его афинности к отрицательно заряженным фосфолипидам более чем в 100 раз. В результате его баланс антикоагулянтной активности β2-GPI смешается в пользу протромботической функции комплексов АФА с β2-GPI, что приводит к ингибированию пути протеина С, активации коагуляции вследствие увеличения экспрессии тканевого фактора и усиления адгезивной способности тромбоцитов.
Антипротромбиновые антитела. В 1959 г. Locliger описал случай, когда ВА-активность была более выражена в смешанной плазме, чем в собственно плазме пациента. Уровень протромбина в плазме пациента был низкий. Эксперимент адсорбции плазмы пациента с BaSО4 привел исследователя к мысли о том, что протромбин является необходимым кофактором для экспрессии ВА-активности. Идея о том, что протромбин и фосфолипиды (или только протромбин) являются мишенями для «антифосфолипидных» антител, тем не менее, до 1990 г. не находила широкого одобрения, пока не появилось несколько одновременных сообщений о том, что антитела могут быть направлены против β2-GP1.
Антипротромбиновые антитела являются другой большой группой антифосфолипидных антител и обнаруживаются у 50-90% АФА-негативных пациентов. Антипротромбиновые антитела составляют большую часть антител, объединяемых общим названием ВА у больных с АФС. Механизм ВА-активности, вероятно, подобен механизму для b2-GPI-антител. Антитела, перекрестно связанные с протромбином (антипротромбиновые антитела связываются с протромбином при помощи F(ab)2 фрагмента с образованием тримолекулярного комплекса), обладают большой связывающей способностью по отношению к анионным фосфолипидным мембранам, вытесняя остальные коагуляционные факторы и фосфолипид-связывающие протеины (аннексин V, аннексин II и пр.). Кроме того, возможно, что такие антитела могут напрямую взаимодействовать с протромбиназным комплексом или прямо тормозить активацию протромбина в этих комплексах. В 1991 г. Bevers Е. и соавт. показали, что феномен ВА может быть связан с наличием антител к комплексу протромбнн/антифосфолипиды; кроме того, антипротромбиновые антитела тормозят активацию фактора X, которая осуществляется при взаимодействии последнего с факторами Va и VIIIа и которая необходима для превращения протромбина в тромбин. У большинства пациентов феномен волчаночного антикоагулянта обусловлен наличием антител к b2-GPI и антикардиолипинов. В то же время у 15% пациентов феномен волчаночного антикоагулянта связан с циркуляцией антипротромбиновых антител [18].
Эпитопы, которые узнают антипротромбиновые антитела, еще не до конца изучены. Показано связывание антипротромбиновых антител с протромбином, претромбином 1 (карбоксилирвоанным терминальным сегментом протромбина), альфатромбином, фрагментом 1 (фрагмент распада протромбина), однако взаимодействия антипротромбиновых антител с тромбином, иммобилизированным в составе тромба, обнаружено не было. Вероятно, это свидетельствует в пользу поли-/олигоклонального происхождения антипротромбиновых антител. В связи с тем, что N-концевая область молекулы протромбина гомологична участкам молекулы других витаминК зависимых факторов, включая антикоагулянтные протеины С и S, антитела к протромбину могут также перекрестно реагировать с этими фактором.
В 80-е гг. прошлого столетия предпринималось множество исследований для прояснения патогенеза гипопротромбинемии у пациентов с ВА. Было установлено, что гипопротромбинемия является результатом ускоренного клиренса протромбин-антипротромбиновых комплексов из циркуляции. Хотя большинство антипротромбиновых аутоантител, вероятно, являются низкоаффинными, у небольшой группы пациентов ряд исследователей обнаруживали высокоаффинные антипротромбиновые антитела. Такие пациенты с высокоаффинными антителами, в отличие от пациентов с низкоаффинными антителами и АФС, имели скорее тенденцию к кровотечениям, нежели к тромбозам. Это довольно интересная ситуация, когда аутоантитела с одинаковой специфичностью, но с разной аффинностью могут иметь различные клинические эффекты.
Механизм развития тромбозов и осложнений беременности у пациентов с антипротромбиновыми антителами остается до конца не ясным. Показано, что антипротромбиновые антитела увеличивают продукцию тромбина на поверхности эндотелия. Такой эффект, возможно, обусловлен иммобилизацией протромбина на фосфолипидной поверхности мембран под действием антител к протромбину (см. рис. 6). Таким образом, антпротромбиновые антитела с ВА-активностью могут обладать протромботическими свойствами. В последних исследованиях было показано, что количество антител к β2GP1 и протромбину не всегда коррелирует с вероятностью тромботических осложнений. Более того, антитела к протромбину были обнаружены у совершенно здоровых людей. В связи с этим было предположено, что существует фракция так называемых «активных» антител, которые и определяют риск тромбозов. Для подтверждения этой гипотезы были исследованы образцы плазмы 198 пациентов с аутоиммунными заболеваниями. Исследование показало, что только антитела к β2GP1 с ВА-активностью приводят к высокому риску тромботических осложнений. Связи антител к β2GP1 без ВА-активности с тромботическими осложнениями отмечено не было. Также не была выявлена подобная связь по отношению к протромбиновым антителам. На основании этих данных для определения риска тромбозов наиболее целесообразным является определение как ВА, так и антител к β2GP1 методом ELISA.
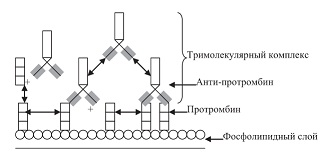 | Рисунок 6: Антитела к протромбину образовывают с протромбином тримолекулярный комплекс на фосфолипидной мембранной поверхности. |
Антитела к аннексину V. В последнее время одна из ведущих ролей в патогенезе АФС отводится аннексину V. Аннексин V обладает мощными антикоагулянтными способностями in vitro, основанными на высокой аффинности к анионным фосфолипидам. Аннексин V формирует гроздья на «незащищенных» фосфолипидах, т.е. образует протективный щит на фосфолипидной поверхности, который блокирует способность фосфолипидов к реакциям коагуляции. Тромбофилия при АФС является следствием уменьшения аннексинаV на апикальной поверхности плацентарного трофобласта и сосудистых эндотелиальных клеток, когда эти клетки вступают в контакт с текущей кровью. АннексинV вытесняется АФА, высокая аффинность которых является следствием формирования бивалентных комплексов с β2GP1 на поверхности фосфолипидной мембраны. Антитела влияют на формирование щита и обнажают на окружающей поверхности повышенное количество фосфолипидов, готовых начать коагуляционные реакции. АФА-опосредованное усиление связывания протромбина с трофобластом в присутствии аннексина V, вероятно, происходит также подобным образом [16].
Разрушение аннексинового щита в условиях АФС является причиной тромбозов и репродуктивных потерь. Эти механизмы можно описать следующим образом. При активации и повреждении эндотелия и тромбоцитов активируется экспрессия анионных фосфолипидов. С участком повреждения связывается аннексин V, предотвращая коагуляцию. Мономерный β2-GPI обладает меньшей афинностью по сравнению с аннексином V. В условиях АФС сначала происходит обратимое связывание мономеров β2-GPI с фосфолипидами. В результате экспрессируется эпитоп G40-R43 β2-GPI, что, в свою очередь, влечет за собой конформационные изменения в молекуле β2-GPI. Теперь одна молекула β2-GPI приобретает способность связываться с двумя антигенами. Это приводит к повышению афинности β2-GPI к фосфолипидам, вытеснению аннексина V и активации коагуляции [16] (см. рис. 7).
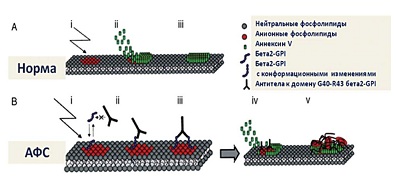 | Рисунок 7: Механизм разрушения аннексинового щита в условиях АФС. |
Механизмы патогенетических эффектов АФА. Нерешенным остается вопрос, почему у одних пациентов выявляется циркуляция АФА без какихлибо клинических проявлений, в то время как у других развивается яркая клиническая картина с рецидивирующими тромбозами и акушерскими осложнениями, почему у одних больных развиваются венозные тромбозы, а у других – тромбозы и эмболии в артериальном русле. Существуют предположения о том, что клиническая картина при АФС определяется классами циркулирующих антител и их сочетаниями (см. рис. 8).
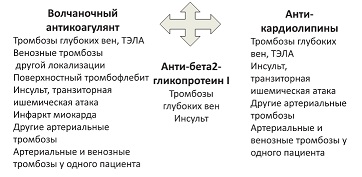 | Рисунок 8: Взаимосвязь разных видов АФА с тромботическими осложнениями (P<0,05). |
При рассмотрении патогенеза тромбозов в условиях АФС становится понятным, что АФА влияют на все механизмы регуляции свертывания крови, полностью смещая баланс в пользу прокоагулянтного потенциала (см. рис. 9). Их влияние распространяется на все звенья системы гемостаза, включая функцию естественных антикоагулянтов, регуляцию фибринола, первичный и вторичный гемостаз, защитные свойства эндотелия. При этом эффекты АФА характеризуются плейотропностью, реализуюсь за счет влияния на различные компоненты системы свертывания крови.
 | Рисунок 9: Способность АФА полностью разрушать механизмы регуляции жидкого состояния крови. |
Однако прежде чем детально рассмотреть механизмы влияния АФА на различные звенья системы гемостаза, мы считаем необходимым вкратце остановиться на вопросах регуляции свертывающей системы крови в норме.
Нормальное функционирование системы гемостаза. Функция системы гемостаза в норме обеспечивается за счет слаженного взаимодействия нескольких систем: плазменных факторов свертывания крови, естественных антикоагулянтов, про и антифибринолитиков, эндотелиального барьера и клеток крови, прежде всего, тромбоцитов.
Поврежденный эндотелий экспрессирует тканевый фактор (TF), который является мощным инициатором коагуляции и регулятором воспалительного ответа. TF, образуя комплекс с фактором VIIa, участвует в активации как внешнего, так и контактного пути коагуляции. Комплекс TF – VIIa может активировать фактор X по двум механизмам. Непосредственная активация фактора X с помощью комплекса TF – VIIa носит название классического пути, тогда как альтернативный путь включает превращение связанного с эндотелием фактора IX в 1Ха, который в присутствии фактора VIIIa и Са2+ превращает фактор X в Ха. Таким образом, участвуя в активации фактора IX, TF потенцирует внутренний путь свертывания крови. Фактор Ха, образующийся через внешний и внутренний пути, совместно с фактором Va, связанным с поверхностью тромбоцитов и фосфатидилсерином тромбоцитарных мембран, в присутствии Са2+ формирует активную протромбиназу, которая обеспечивает образование тромбина (фактора IIа). Тромбин, в свою очередь, превращает фибриноген в фибрин, а также активирует факторы VIII и V. Фактор VIIIa совместно с фактором IХа значительно увеличивает количество фактора Ха по механизму положительной обратной связи, а фактор Va способствует образованию активной протромбиназы, что приводит к многократной амплификации реакции образования тромбина. В свою очередь, тромбин является мощным активатором тромбоцитов. Первоначальная адгезия тромбоцитов при участии фактора Виллебранда эндотелия и тромбоцитарных рецепторов Ib стимулирует активацию рецепторных изменений. Это приводит к формированию прочной адгезии тромбоцитов к субэндотелиальному матриксу, прежде всего, за счет связывания тромбоцитарных рецепторов IIb/IIIa с коллагеном и последующей дегрануляции тромбоцитов с высвобождением целого спектра протромботических факторов.
В норме преобладает профибринолитическая активность. Это связано с экспрессией на поверхности эндотелия активаторов плазминогена тканевого и урокиназного типа (t-PA, u-PA), а также их рецепторов (t-PAR, u-PAR). Активаторы плазминогена являются сериновыми протеазами и катализируют превращение плазминогена в плазмин.
К основным естественным антикоагулянтнам относятся: антитромбин III (AT III), ингифбитор тканевого фактора (TFPI), антикоагулянтный путь PC. AT III обнаружен в плазме крови, а также на микрососудистом эндотелии, где он связан с анионными гликозаминогликанами, например, с гепарин и гепарансульфатами, которые выступают в роли катализатора AT III. Гепарин вызывает конформационные изменения молекулы AT III, повышает сродство AT III к факторам свертывания крови и в несколько тысяч раз увеличивает степень их ингибиции. В присутствии гепарина становится значимым блокирующее влияние AT III на фактор XI и калликреин.
TFPI (Tissue Factor Pathway Inhibitor) является ингибитором пути тканевого фактора (ингибитором внешнего пути свертывания крови). TFPI является важнейшим ингибитором комплекса VIIIa – TF, а также эффективным ингибитором и регулятором катаболизма фактора Ха.
Эндотелий представляет собой основную поверхность, где происходит активация пути PC. Этот путь является важнейшим компонентом антикоагулянтной системы организма и включает в свой состав тромбомодулин (ТМ), PC и PS, эндотелиальные рецепторы PC и EPCR.
Важнейшим антикоагулянтным фактором является ТМ. Он представляет собой трансмембранный протеин, локализованный на поверхности эндотелиоцитов; выступает в качестве высокоаффинного рецептора тромбина, изменяет конформацию последнего и снижает его прокоагулянтные свойства. Антикоагулянтная функция ТМ реализуется за счет следующих механизмов: 1) инактивации тромбина и уменьшения содержания его активной формы в плазме; 2) обеспечения эндоцитоза тромбина; 3) повышения восприимчивости связанного с ТМ тромбина к ингибиции AT III; 4) инициации антикоагулянтного пути PC с помощью комплекса ТМ – тромбин.
Комплекс ТМ – тромбин способствует образованию АРС из плазменного предшественника – протеина С. Активность PC и АРС повышается при их связывании со специфическими рецепторами на эндотелии – EPCR.
АРС является сериновой протеазой, обладающей антитромботическими и противовоспалительными свойствами; ингибирует факторы Va и VIIIa путем протеолиза, ограничивая тем самым генерацию двух ключевых энзимов процесса коагуляции – фактора Ха и тромбина. Для ингибирования факторов Va и VIIIa посредством АРС требуется наличие кофактора – PS. Последний представляет собой витамин К-зависимый гликопротеин плазмы, но не является зимогеном. PS обладает рядом важных свойств: 1) увеличивает аффинность связи EPCR с РС/АРС; 2) в несколько раз повышает степень инактивации факторов Va и VIIla под действием АРС; 3) предотвращает комплексообразование коагуляционных энзимов с факторами Va и VIIIa. Около 60% PS плазмы находится в связанном состоянии с С4b-связывающим протеином (С4Вр) – протеином острой фазы и отрицательным регулятором пути комплемента. С4Вр нейтрализует антикоагулянтную активность протеина S, способствуя развитию процессов воспаления и коагуляции.
Роль эндотелия в патогенезе тромбофилии при АФС. Эндотелий играет важную роль в регуляции системы гемостаза (см. табл. 6).
Таблица 6. Механизмы, обеспечивающие про- и антикоагуляционную активность эндотелия.
| Механизмы | Антикоагуляционный эффект | Прокоагуляционный эффект |
|---|
| Воздействие на плазматические факторы | Гликозаминогликан/АТIII
TFPI
Тромбомодулин | Образование связей для факторов IX/IXa, X/Xa, XII, калликреина
Клеточный фактор
Рецепторы для тробина, протеина С/АРС | | Активация тромбоцитов | Простациклин
NO
АДФ-аза |
Фактор фонВиллебранда
PAF
Фибриноген
Факторы V, XI | | Фибринолиз | tPA
uPA
uRAR, плазминоген, аннексин | PAI-1, PAI-2
Ингибитор протеина С
TAFI | | Регуляция сосудистого тонуса | NO
Простациклин | Тромбоксан
Эндотелин-1 |
В связи с этим возникла гипотеза о том, что он может являться мишенью для АФА. В экспериментах было отмечено, что ВА-положительная плазма способна подавлять продукцию простациклина эндотелиальными клетками (ЭК), а также вызывать дисбаланс между эндотелиальным простагландином I2 (PgI2) и тромбоцитарным тромбоксаном А2 (ТхА2). Более того, большая часть исследований показала, что АФА связывается с ЭК. АнтителоЭК опосредованное повреждение и активация ЭК идентифицированы как значительный потенциирующий фактор, который может участвовать в патогенезе тромбозов у пациентов с АФА. Превращение нормального антитромботического статуса эндотелия в протромботический статус может явиться первичным патофизиологическим моментом в приобретенном гиперкоагуляционном состоянии при АФС. Некоторые данные свидетельствуют о том, что активация ЭК АФА происходит путем повышения экспрессии эндотелиальноклеточных молекул адгезии. В то же время молекулярная адгезия способна сама по себе активировать лейкоциты, активированные моноциты также способны проявлять прокоагулянтную активность. Del Papa N. (1995) первым продемонстрировал, что АФА или анти b2GP1 антитела повышают экспрессию молекул адгезии, и этот эффект напрямую зависит от связывания с АФА и ИЛ-1a, с индукцией ИЛ-6 вместе с продуцированием ИЛ-1b, который, с другой стороны, повышает экспрессию молекул адгезии.
Основными механизмами патогенеза тромбофилии при АФС, связанными с повреждением функции эндотелия, являются следующие:
1. Подавление синтеза эндотелиальными клетками простациклина – наиболее мощного естественного ингибитора агрегации тромбоцитов и вазодилататора.
2. Снижение активности антитромбина III.
3. Повреждение мембран эндотелиальных клеток с экспозицией анионных фосфолипидов и индукция синтеза тканевого фактора (TF), что приводит к запуску внутреннего пути свертывания крови. Активированные эндотелиоциты экспонируют в больших количествах фактор фон Виллебранда и фибронектин, что также увеличивает свертывающий потенциал крови.
4. Образование антиэндотелиальных антител.
5. Формирование провоспалительного фенотипа эндотелия. Взаимодействие АФА с эндотелием приводит к активации эндотелиальных клеток, что проявляется в увеличении экспрессии молекул адгезии (Е-селектина, ICAM-1, VCAM-1), продукции пpoвocпaлитeльныx цитoкинoв (TNF-a, IL-lb, IL-6).
|