НАРУШЕНИЯ ПРОЦЕССОВ РЕГУЛЯЦИИ АНГИОГЕНЕЗА И СКЛЕРОЗИРОВАНИЯ ПРИ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССАХ ЭНДОМЕТРИЯ.
Шешукова Н.А.1, Макаров И.О.1, Федотова А.С.2 Дата публикации на сайте: 2012-11-10 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Проведено патоморфологическое и иммуногистохимическое исследование соскобов эндометрия. Высокая пролиферативная активность сосудисто-эндотелиального фактора роста (СЭФР) и повышенная экспрессия трансформирующего фактора роста β1 (ТФРβ1), фибронектина и лизилоксидазы у пациенток с атипической гиперплазией эндометрия и при сопутствующем хроническом эндометрите свидетельствует о наличии клеточной гипоксии, нарушении межклеточного и клеточно-матриксного взаимодействия и может считаться негативным прогностическим фактором.
Ключевые слова: гиперпластические процессы эндометрия, хронический эндометрит, сосудисто эндотелиальный фактор роста, трансформирующий фактор роста бета1, фибронектин, лизилоксидаза
1 ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздравсоцразвития России, Москва
2 ГКБ № 14 им. В.Г. Короленко, Москва
В настоящее время остаются актуальными вопросы, посвященные изучению механизмов ангиогенеза и склерозирования – важных компонентов в развитии многих физиологических и патологических пролиферативных процессов, одним из которых является гиперплазия эндометрия.
В локальном регулировании процессов пролиферации и апоптоза в эндометрии принимают участие факторы роста – полипептиды, инициирующие внутриклеточные сигнальные пути и стимулирующие деление и дифференцировку различных типов клеток. Среди наиболее важных клеточных регуляторов можно выделить сосудисто-эпидермальный (СЭФР) и трансформирующий факторы роста (ТФР) [1,3]. СЭФР представляет собой гликопротеин, стимулирующий пролиферацию эндотелиальных клеток сосудов. ТФРβ1 оказывает многогранное действие на ангиогенез, пролиферацию и процессы склерозирования.
Особенность клеточной активности эндометрия зависит также от микроокружения клетки. Одним из стабилизаторов клеточного матрикса является лизилоксидаза (LOX) – медьсодержащая аминооксидаза. LOX участвует в контроле внутриклеточной активности и является мессенджером, переносящим информацию между внутренним содержимым и окружением клетки, т.е. участвует в клеточно-матриксном взаимодействии [4].
Одним из ключевых компонентов экстрацеллюлярного матрикса является фибронектин – белок, способствующий адгезии и распространению эпителиальных и мезенхимальных клеток, стимулирующий пролиферацию и миграцию опухолевых клеток, а также контролирующий дифференцировку и поддержание цитоскелета клеток [2].
Целью настоящего исследования явилось изучение особенностей процессов ангиогенеза и склерозирования при различных вариантах гиперпластических процессов эндометрия.
Материалы и методы
Основную группу составили 150 пациенток, у которых, по данным гистологического исследования ткани эндометрия, полученной при раздельном лечебно-диагностическом выскабливании матки, был выставлен гиперпластический процесс эндометрия. Контрольную группу составили 30 женщин с неизмененным эндометрием в фазе пролиферации.
Все женщины были пременопаузального периода. Возраст пациенток составил в среднем 48,2±2,9 лет. Показаниями для госпитализации женщин в гинекологическое отделение ГКБ № 14 явилось наличие маточного кровотечения различного характера и/или наличие патологических изменений эндометрия по данным УЗИ.
Критериями включения женщин в основную группу исследования послужили: пременопаузальный период, наличие гиперпластического процесса эндометрия, отсутствие острых воспалительных процессов органов малого таза, отсутствие онкологических заболеваний в анамнезе.
В зависимости от варианта гиперпластического процесса эндометрия были отобраны наблюдения и сформированы четыре группы.
I группа – 30 женщин с простой гиперплазией эндометрия без атипии, II группа – 30 пациентки со сложной гиперплазией эндометрия без атипии, III группа – 30 женщин с атипической гиперплазией эндометрия и IV группа – 30 пациенток с простой гиперплазией эндометрия, осложненной хроническим эндометритом.
Комплексное обследование женщин включало сбор анамнеза, оценку соматического статуса, менструальной и репродуктивной функций.
Морфологическое исследование проводили в Московском городском центре патологоанатомических исследований при Городской клинической больнице № 14 им. В.Г. Короленко и кафедре патологической анатомии ГОУ ВПО «Московский государственный медико-стоматологический университет» Минздравсоцразвития России (руководитель центра и зав. кафедрой – проф. О.В. Зайратьянц).
Гистологический метод. Полученный материал фиксировали в 10%-м нейтральном забуференном формалине и по общепринятой методике заливали в парафиновые блоки. Изготовленные из них на микротоме «Leica» (Германия) гистологические срезы толщиной 4-5 мкм (не менее двух срезов с каждого блока) окрашивали гематоксилином и эозином. Препараты изучали и фотографировали, используя микроскоп «Leica DM LB» (Германия) с цифровой фотокамерой «Olympus» (Япония).
Для иммуноморфологического исследования использовали иммунопероксидазный метод с применением первичных специфических моноклональных антител к следующим антигенам: сосудисто-эндотелиальному фактору роста (СЭФР, клон G153-694), трансформирующему фактору роста – β-1 (ТФРβ1), фибронектину.
Экспрессию лизилоксидазы (LOX) определяли с помощью иммуногистохимического исследования, которое проводилось методом непрямой иммуно-флюоресценции с использованием специфических поликлональных антител к лизилоксидазе на парафиновых срезах.
Результаты
Изучение экспрессии СЭФР показало, что она наиболее выражена в контрольной группе – неизмененном эндометрии в фазу пролиферации, причем как в эпителии желез, так и в строме.
Экспрессия СЭФР в эпителии желез и клетках стромы по сравнению с контрольными наблюдениями была достоверно уменьшена при простой и сложной гиперплазии эндометрия. При атипической гиперплазии она повышалась, но не достигала показателей контрольной группы. Причем при атипической гиперплазии эндометрия экспрессия СЭФР отличалась выраженной неравномерностью в пределах одних и тех же желез и в разных участках стромы.
В подгруппе наблюдений с простой гиперплазией эндометрия, осложненной развитием хронического эндометрита, показатели экспрессии СЭФР в клетках желез были сходны с наблюдаемыми при простой и сложной гиперплазии, а в строме – значительно повышались, превосходя как показатели контрольной группы, так и показатели при других формах гиперплазии (см. табл. 1).
Таблица 1. Экспрессия СЭФР в подгруппах исследованного материала (n=30).
| Показатель СЭФР | Эндометрий, фаза пролиферации | Простая гиперплазия | Сложная гиперплазия | Атипическая гиперплазия | Простая гиперплазия, осложненная хроническим эндометрии-том |
|---|
| Эпителий желез | 2,2±0,09 | 1,8±0,03* | 1,7±0,15* | 1,9±0,14 | 1,9±0,07 | | Клетки стромы | 0,8±0,07 | 0,6±0,04 | 0,6±0,09 | 0,8±0,13 | 1,5±0,06* |
Примечание. Здесь и в таблице 2: *достоверность различий (р<0,05) по сравнению с контрольной группой,
**по сравнению с подгруппой простой гиперплазии.
Таким образом, экспрессии СЭФР, по сравнению с неизмененным эндометрием в фазе пролиферации, достоверно ниже при разных видах гиперплазии эндометрия как в эпителии желез, так и в строме.
Экспрессия СЭФР несколько повышалась в строме и в эпителии желез при атипической гиперплазии эндометрия, но эти различия были статистически недостоверны. При этом виде гиперплазии была характерна неравномерная экспрессия СЭФР в разных железах и участках стромы.
Вероятно, сниженный по сравнению с фазой пролиферации неизмененного эндометрия уровень экспрессии СЭФР при разных видах его гиперплазии может приводить к недостаточной активности процессов ангиогенеза в растущей ткани эндометрия и, наряду с тромбозом сосудов, является причиной его очаговой ишемии. Гиперэкспрессия СЭФР в строме, отмеченная в подгруппе наблюдений с простой гиперплазией эндометрия, осложненной хроническим эндометритом, является следствием воспалительного процесса и усиливает ангиогенез.
В контрольной группе наблюдений экспрессия ТФРβ1 была выражена минимально как в эпителии желез, так и в строме. Экспрессия ТФРβ1 в эпителии желез и клетках стромы по сравнению с контрольными наблюдениями была повышена при простой и сложной гиперплазии эндометрия. При атипической гиперплазии продукция и накопление ТФРβ1 были несколько выше, чем в неизмененном эндометрии и достоверно высокими – в стромальных клетках по сравнению и с вариантом нормы и при простой и сложной гиперплазии.
В подгруппе наблюдений с простой гиперплазией эндометрия, осложненной развитием хронического эндометрита, в строме показатели экспрессии ТФРβ1 были значительно и статистически достоверно выше, чем в контрольных наблюдениях и при простой, и сложной гиперплазии (см. табл. 2).
Таблица 2. Экспрессия ТФРβ1 в подгруппах исследованного материала (n=30).
| Показатель ТФРβ1 | Эндометрий, фаза пролиферации | Простая гиперплазия | Сложная гиперплазия | Атипическая гиперплазия | Простая гиперплазия, осложненная хроническим эндометритом |
|---|
| Эпителий желез | 0,3±0,02 | 0,8±0,02* | 0,9±0,05* | 0,6±0,07 | 1,3±0,06 | | Клетки стромы | 0,2±0,01 | 036±0,02 | 0,5±0,03* | 1,1±0,08*, ** | 1,4±0,04*, ** |
Таким образом, экспрессия ТФРβ1 по сравнению с неизмененным эндометрием в фазе пролиферации оказалась достоверно выше в эпителии желез при простой, сложной и атипической гиперплазии эндометрия. В строме экспрессия ТФРβ1 повышается при сложной и атипической гиперплазии. При этом в разных наблюдениях при всех видах гиперплазии и в разных участках образцов эндометрия показатели его экспрессии значительно варьируют. Высокий уровень экспрессии ТФРβ1 при хронических воспалительных процессах в эндометрии сопровождается нарастанием склероза стромы эндометрия.
Исследование экспрессии фибронектина показало, что она минимальна и равномерно выражена в неизмененном эндометрии в фазе пролиферации, а также при простой и сложной гиперплазии эндометрия. При атипической гиперплазии экспрессия фибронектина также была слабой или местами умеренной. Однако в наблюдениях простой гиперплазии, осложненной хроническим эндометритом, или при хроническом эндометрите с реактивной гиперплазией эндометрия экспрессия фибронектина резко усиливалась, особенно в очагах склероза (см. рис. 1-4).
 | Рисунок 1. Неизмененный эндометрий в фазу пролиферации. Слабая равномерная экспрессия фибронектина в строме. Непрямой иммунопероксидазный метод с антителами к фибронектину, x 400. |
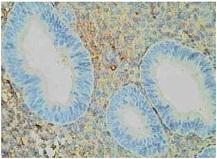 | Рисунок 2. Простая гиперплазия эндометрия. Умеренная равномерная экспрессия фибронектина в строме. Непрямой иммунопероксидазный метод с антителами к фибронектину, x 400. |
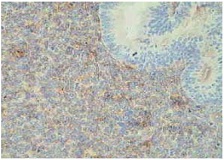 | Рисунок 3. Атипическая гиперплазия эндометрия. Умеренная равномерная экспрессия фибронектина в строме. Непрямой иммунопероксидазный метод с антителами к фибронектину, x 400. |
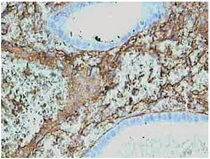 | Рисунок 4. Простая гиперплазия эндометрия, осложненная хроническим эндометритом. Выраженная и неравномерная экспрессия фибронектина в строме. Непрямой иммунопероксидазный метод с антителами к фибронектину, x 400. |
При иммуногистохимическом исследовании продукции LOX выявлено, что при разных видах гиперплазии эндометрия экспрессия LOX статистически достоверно возрастает по мере прогрессирования патологического процесса (см. табл. 3). Наблюдения с сочетанием простой гиперплазии и хронического эндометрита занимают «промежуточное» положение между сложной типической и атипической гиперплазией.
Между неизмененным эндометрием в разных фазах и простой и сложной гиперплазией эндометрия нет достоверной разницы в количестве клеток, содержащих лизилоксидазу. Количество этих клеток составило от 18 до 49 в поле зрения микроскопа площадью 0,0384 мм2.
При атипической гиперплазии эндометрия число клеток с положительной реакцией на лизилоксидазу было максимальным и составило от 52 до 80 клеток, в среднем 68±6 клеток в поле зрения микроскопа площадью 0,0384 мм2. При этом увеличивалось количество таких клеток как в железах, так и в строме эндометрия.
Достоверно высокий уровень экспрессии LOX у пациенток с простой гиперплазией в сочетании с хроническим эндометритом и при атипической гиперплазией эндометрия свидетельствует о наличии клеточной гипоксии и нарушении межклеточного и клеточно-матриксного взаимодействия в ткани эндометрия, что позволяет отнести эти группы наблюдений к группе высокого риска возможной малигнизации.
Таким образом, хронический воспалительный процесс способствует усилению межклеточных и стромально-паренхиматозных нарушений, уже имеющихся при гиперпластических процессах эндометрия или предрасполагающих к их развитию. Это приводит к активации процессов склерозирования, неоангиогенеза и формированию гипоксии, потенцирующих пролиферативную активность железистого эпителия и, особенно, стромы гиперплазированного эндометрия, создавая, в свою очередь, оптимальные условия для формирования и прогрессирования опухолевого процесса.
Литература:
1. Кузнецова И.В. Гиперпластическое процессы эндометрия. М. 2009; 48 с.
2. Пальцев М.А., Иванов А.А. Межклеточные взаимодействия. М., 1995, 224 с.
3. Ferrara N. // Recent Progr. Hormone Res. 2000; 55: 15-36.
4. Erler J.T., Giaccia A.J. Lysyl oxidase mediates hypoxic control of metastasis. Cancer Res. 2006; 66 (21): 10238-41.
INFRINGEMENT OF ANGIOGENESIS AND SCLEROSIS REGULATION PROCESSES IN HYPERPLASTIC ENDOMETRIUM
Sheshukova N.A., Makarov I.O., Fedotova A.S.
First Moscow State Medical University named after I.M. Sechenov
City Hospital #14 named after V.G. Korolenko, Moscow
Abstract: pathomorphological and immunohistochemical studies оf endometrium were performed. The higher proliferative activity of the VEGF and the higher production of transformation growth factor β1 (TGFβ1), fibronectin and liziloxydaza in patiens with atypical hyperplasia of endometrium and chronic endometritis testifies the presence of cellular hypoxia, disturbance of intercellular and extracellular interaction and can be considered as the negative prognostic factor.
Key words: hyperplastic processes of endometrium, chronic endometritis, liziloxydaza, vascular endothelial growth factor, transformation growth factor β1, fibronectin. |
|