МЕДИКО-ГЕНЕТИЧЕСКИЕ АСПЕКТЫ БЕСПЛОДИЯ.
Гончарова Н.Н.1,Мартышкина Е.Ю.1,Казначеева Т.В.1,Арсланян К.Н.1,Адамян Л.В.1,Курило Л.Ф.2,Сорокина Т.М.2,Черных В.Б.2 Дата публикации на сайте: 2012-07-10 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Представлены результаты медико-генетического обследования 304 супружеских пар с бесплодием (608 индивидуумов). Выявлена частота генетических аномалий, представлена структура бесплодия. Проведён сравнительный анализ двух групп, в которые вошли пары с мужским и сочетанным бесплодием. Группы были сформированы по результатам лечения бесплодия с использованием ВРТ. Выявлены факторы, достоверно влияющие на наступление беременности.
Ключевые слова: бесплодие в браке, мужское бесплодие, сочетанное бесплодие, цитогенетический анализ, молекулярно генетическое исследование, хромосомные аномалии, хромосомные варианты, ВРТ
1 Кафедра репродуктивной медицины и хирургии ФПДО МГМСУ
2 Медико-генетический научный центр РАМН (Москва)
Бесплодие в браке – одна из наиболее важных и сложных медицинских, социально-демографических и экономических проблем. Частота бесплодных браков во многих странах мира колеблется от 8 до 29%. В Европе бесплодными являются около 10% супружеских пар, в США – 15%, в Канаде – 17%, доля бесплодных браков на территории России варьирует от 8 до 17,5%. Бесплодие как социальная проблема часто является причиной потери интереса к жизни, работе, развития тяжелых психосексуальных и эмоциональных расстройств [1,2].
Современная диагностическая и лечебная помощь при бесплодии опирается на основополагающие достижения в области репродукции, к которым относятся: расшифровка механизмов гормональной регуляции репродуктивного процесса, ультразвуковая диагностика, эндоскопическая хирургия, вспомогательные репродуктивные технологии. Тем не менее, в 8-10% случаев установить причину бесплодия не представляется возможным, что связано с большим числом разнообразных факторов, влияющих на репродуктивный процесс [2,3,4]. По данным некоторых авторов, на долю идиопатического бесплодия у мужчин приходится до 30% случаев [5]. Их связывают с ещё недостаточно изученными генетическими аспектами регуляции сперматогенеза [5], определённая доля случаев может относиться к патологии мейоза, нарушению дифференцировки и созревания сперматид в зрелую половую клетку и др. [4]. Но при использовании в диагностике молекулярно-генетических, молекулярно-цитогенетических, электронно-микроскопических методов частота выявления нарушений репродуктивной функции генетической природы значительно возрастает.
Цель нашего исследования – уточнение структуры и определение роли генетических нарушений при бесплодии.
Материалы и методы
В исследование включено 608 человек: 304 супружеские пары с бесплодием. Критерии включения: супружеские пары с мужским или женским бесплодием; супружеские пары с сочетанным бесплодием. Критерии исключения: злокачественные новообразования; тяжелая экстрагенитальная патология; наличие психических заболеваний.
Средний возраст мужчин составил 35,3±6,6 лет, средний возраст женщин – 32,1±5,7 года. Продолжительность бесплодия – 5,3±3,8 года (min – 1 год, max – 20 лет). Доля пациентов с первичным бесплодием составила 77,6% (мужчин – 82%, женщин – 72%), с вторичным – 22,4% (мужчин – 18%, женщин – 28%).
Всем пациентам был проведен цитогенетический анализ по лимфоцитам периферической крови, культивируемых в условиях in vitro, в соответствии со стандартной процедурой. Исследование проводили на препаратах метафазных хромосом, которые готовили по общепринятому методу. Результаты цитогенетического исследования приведены согласно Международной системе номенклатуры цитогенетики человека (ISCN, 2005). При подозрении на мозаицизм как мужчинам, так и женщинам проводили молекулярно-цитогенетическое исследование лимфоцитов крови для уточнения процентного соотношения линий клеток.
Из общей группы супружеских пар, прошедших цитогенетическое обследование, была выделена 161 супружеская пара с сочетанным или мужским фактором бесплодия. Эти пары были полностью обследованы и прошли лечение в специализированных клиниках с использованием ВРТ. Проведено одномоментное ретроспективное исследование. Супружеские пары были разделены на две группы: группа 1 – беременность наступила и длилась более 12 нед. (68 супружеских пар), группа 2 – беременность не наступила или прервалась до 12 нед. беременности (93 супружеские пары). Данные о пациентах вносились в специально разработанную таблицу, которая включала в себя 132 параметра. Статистическую обработку результатов исследований проводили с помощью пакета прикладных программ Statistica 6.0. Статистический анализ данных включал оценку формы распределения признака по критериям Колмогорова-Смирнова. Поскольку распределение признаков отличалось от нормального, были использованы непараметрические методы: критерий Манна-Уитни для оценки межгрупповых различий, ранговая корреляция Спирмена для оценки силы связи между изучаемыми факторами. Оценка влияния разных факторов на успех наступления беременности была проведена с помощью многофакторного регрессионного анализа.
Результаты исследования
Обследовано 608 человек с бесплодием (304 супружеские пары). Общая частота выявленных хромосомных аномалий составила 1,3% (8 человек), их них было выявлено равное количество числовых и структурных хромосомных аномалий (по 0,65%). Среди числовых хромосомных аберраций определены: синдром Клайнфельтера полная и мозаичная форма (2 случая – кариотипы 47,ХХУ и 46,ХУ/47,ХХУ), мозаичная форма моносомии хромосомы Х (1 случай – 46,ХХ/45,Х), мозаичная форма синдрома трипло-Х (1 случай – 46,ХХ/47,ХХХ). Среди структурных аномалий были выявлены сбалансированные транслокации с вовлечением как аутосом, так и половых хромосом: кариотип 46,Х,t(20;Y)(p13;q11.21) и 46,Х,-Y,der(22) t(Y;22), а также инверсии: кариотип 46,ХХ,inv9(p12,p24) и 46,ХУ,inv7(p22, q21).
В 2% случаев (12 человек) при исследовании кариотипа были выявлены хромосомные варианты, связанные с увеличением гетерохроматиновых районов хромосом или инверсией околоцентромерного гетерохроматина: 46 ,ХХ, 21 ps+; 46, ХХ, 21 pstr+; 46, ХХ, 9 ph; 46, ХУ (У больше N); 46, ХY sqh-; 46, XY, 13 cenh; 46, ХУ qh+; 4 6, XY, 22 рs+; 46, ХУ, 15 ps+.
При сравнении двух групп супружеских пар с сочетанным и мужским бесплодием, у которых в результате лечения с применением ВРТ наступила (группа I) и не наступила (группа II) беременность, статистически значимых различий по возрасту мужчин и женщин, продолжительности бесплодия в этих группах выявлено не было. Характеристика групп по возрастам представлена в таблице 1.
Таблица 1. Возрастная характеристика обследованных групп.
| Признак | Женщины | Мужчины | | группа I | группа II | группа I | группа II | | Средний возраст | 30,3 | 32,1 | 34,8 | 35,3 | | Минимальный возраст | 22 | 21 | 24 | 21 | | Максимальный возраст | 39 | 47 | 49 | 56 | | Стандартное отклонение | 4,4 | 5,7 | 5,4 | 6,6 | | U критерий (критерий Манна-Уитни) | p=0.07 (p>0.05) | p=0.81 (p>0.05) |
Средняя продолжительность бесплодия в первой группе составила 5,2±3,5 лет, во второй – 5,5±3,9 лет. В группе, где беременность наступила, преобладало первичное бесплодие – 75%, во второй группе первичное и вторичное бесплодие распределилось практически поровну: 49,5 и 50,5% соответственно.
Факторы бесплодия в группах представлены в таблице 2. Количество пар с мужским бесплодием и соотношение факторов женского бесплодия в парах с сочетанным бесплодием практически не отличались. Исключение составил один показатель. Во второй группе в 1,7 раза было больше женщин с эндометриозом.
Таблица 2. Факторы бесплодия в исследуемых группах.
| Женский фактор | Группа I | Группа II | сочетанное бесплодие
мужской фактор + | мужское бесплодие | сочетанное бесплодие
мужской фактор + | мужское бесплодие | | ТПБ | 41,17% | 39,7% | 43% | 34,4% | | Эндокринное бесплодие | 27,9% | 26,9% | | Эндометриоз | 14,7% | 24,7% |
В структуре патозооспермии у мужчин как в первой, так и во второй группе преобладала астенотератозооспермия, далее следовали: азооспермия, астенозооспермия и тератозооспермия (см. рис.1).
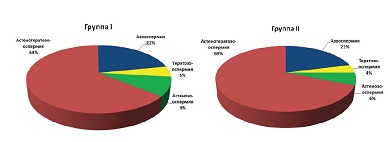 | Рисунок 1: Формы патозооспермии в группах. |
При тяжёлой форме патозооспермии мы проводили молекулярно-цитогенетические исследования половых клеток. Мужчин с азооспермией обследовали на наличие микроделеций в локусе AZF хромосомы У, на наличие мутаций в гене трансмембранного регуляторного белка муковисцидоза, проводили анализ длины GAG повтора в гене AR. Результаты обследования приведены в таблице 3. Частота выявленных микроделеций или генных нарушений в группе мужчин с тяжёлыми формами патозооспермии (31 человек) составила 16%.
Таблица 3. Структура хромосомных аберраций в исследуемых группах.
| Хромосомные аберрации | Группа I | Группа II | | мужчины | женщины | мужчины | женщины | | Числовые ХА | 46, XY/47, XXY– Б I | | | 46,ХХ /47,ХХХ – Б II | | Структурные ХА (инверсии и транслокации) | 46,ХУ,inv 7(p22, q21) | | 46,Х,t(20;Y)(p13;q11.21) | 46,ХХ, inv 9 (p12, p24) | | Хромосомные варианты | 46, ХY sqh–
46, XY, 22 s+
46, ХУ qh+ | 46, ХХ, 21 pstr+
46, ХХ, 9 ph | 46, ХУ qh+
46, ХУ, 15 ps+
46, XY, 13 cenh
46, ХУ (У>N) | 46, ХХ, 21 s+
46, ХХ, 21 pstk+
46 ,ХХ, 21 ps+ | | Мутации в гене трансмембранного регуляторного белка муковисцидоза | delF508 – Б I
5Т(IVS8-5T) – Б I | | | 5T(IVS8-5T) – Б II | | Микроделеции в локусе AZF хромосомы У | | | AZF-c – Б I | | | Анализ длины СAG повтора в гене AR | 27(CAG) – Б I | | 28(CAG) – Б I | |
Все супружеские пары проходили лечение в специализированных клиниках с использованием ВРТ. По показаниям применяли различные методы лечения. Некоторые пары имели по несколько попыток экстракорпорального оплодотворения или искусственной инсеминации, для анализа использованы результаты последнего протокола. В таблице 4 представлены использованные методы лечения в группах.
Таблица 4. Наступление беременности в зависимости от использованных методов вспомогательной репродукции, %.
| Использованные методы | Группа I | Группа II | | ЭКО | 14,7 | 7,5 | | ЭКО + ICSI | 47 | 48,3 | | ЭКО + ICSI + TESЕ | 6,3 | 4,3 | | ЭКО + ICSI + ДС | 5 | 2,1 | | ЭКО + ДС | 8,8 | 6,4 | | Криоперенос | 19,1 | 19,4 | | ЭКО + IMSI | - | 1 | | ЭКО +ДЯ | - | 1 | | ИИ СД | - | 4,3 | | ПГД | 1 | 4 |
При регрессионном многофакторном анализе влияния различных факторов на наступление беременности в исследуемой группе была получена значимая модель: χ²=9,428; р=0,00065. Выявлено, что достоверно влияет на наступление беременности отсутствие в анамнезе у женщин воспалительных заболеваний органов малого таза (р=0,002; р<0,05) и первичное бесплодие (р=0,007; р<0,05), т.е. вероятность наступления беременности у пар с первичным бесплодием была более высокой, чем у пар с вторичным бесплодием.
Обсуждение результатов
В структуре бесплодного брака на долю мужского бесплодия приходится до 50% случаев, из них 30% – пары только с мужским бесплодием, 20% – пары с сочетанным бесплодием [2,7]. В нашем исследовании сочетанное бесплодие встретилось в 62% случаев, изолированное мужское бесплодие – в 38% случаев, что несколько отличается от литературных данных. Мы связываем это с небольшим числом выборки – 161 супружеская пара.
Доля пациентов с первичным бесплодием составила 77,6%, доля пациентов с вторичным бесплодием – 22,4%, что сравнимо с данными других исследований, где первичное бесплодие у мужчин встречалось в 67-71%, вторичное – в 29-33% случаев [7].
По данным литературы, частота генетических аномалий у пациентов с нарушением репродуктивной функции в среднем не превышает 10% [2,6,7,8]. В нашем исследовании частота хромосомных аберраций у 304 пар с бесплодием (608 человек) составила 1,3%.
В 2% случаев при исследовании кариотипа мы выявили хромосомные варианты (увеличение околоцентромерного гетерохроматина). Несмотря на тот факт, что в номенклатуре цитогенетики хромосомные варианты рассматриваются как особенности нормального кариотипа (ISCN 2005), в литературе остаётся открытым вопрос о влиянии хромосомных вариантов на репродуктивную функцию. Известно, что увеличение околоцентромерного гетерохроматина встречается в общей популяции в 4% случаев, а в супружеских парах с нарушением репродуктивной функции – в 20% случаев [2,9].
Большую часть хромосомных аберраций (ХА) у женщин с бесплодием составляют числовые ХА: синдром Шерешевского-Тернера (кариотип 45,Х, регулярная форма) или мозаичная форма моносомии хромосомы Х. Нами были выявлены: 1 случай мозаичной формы моносомии хромосомы Х и 1 случай мозаичной формы синдрома трипло-Х. По данным литературы, числовые ХА достигают 70% от всего числа хромосомной патологии у женщин, структурные – 30%. Структурные ХА обычно представлены робертсоновскими и реципрокными транслокациями и инверсиями хромосом [6]. У носителей последних нет каких-либо клинических проявлений. Однако существует определённый риск возникновения хромосомных аномалий для их потомства.
Вопрос генных мутаций, приводящих к нарушению репродуктивной функции у женщин, до конца не исследован и в настоящее время продолжается его изучение [6].
Среди мужчин с бесплодием основная доля хромосомной патологии представлена числовыми ХА (до 66%). В частности, доля пациентов с синдромом Клайнфельтера, связанным с появлением в кариотипе дополнительной Х-хромосомы (кариотип 47,ХХY), составляет 7% и достигает 15-20% в группе пациентов с азооспермией [6]. Мы выявили мозаичную форму синдрома Клайнфельтера у одного пациента с азооспермией (один случай на 304 индивидуума). В общей популяции частота этого синдрома составляет 1 случай на 500-800 новорожденных мальчиков.
Подавляющая часть структурных перестроек хромосом у пациентов с мужским бесплодием неясного генеза представлена робертсоновской транслокацией малых акроцентрических хромосом – 13 и 14, т.е. кариотипом 45,ХY; der(13;14). В меньшем числе случаев в структурные аберрации вовлечены хромосомы 1, 5, 15, 21, 22, Y. Это было подтверждено и данными нашего исследования, где мы встретили структурные перестройки 22 и Y-хромосомы, что составило 0,5% случаев.
По данным литературы, при азооспермии более 17% пациентов являются носителями ХА [6,7,10]. С целью выявления микроделеций или генных мутаций некоторым пациентам (31 мужчина) с тяжёлыми формами патозооспермии был проведен молекулярно-генетический анализ локуса AZF, гена CFTR и CAG-повтора гена андрогеновых рецепторов (AR).
Мутации в гене CFTR и микроделеции в локусе AZF Y-хромосомы могут являться причиной некоторых форм азооспермии или олигозооспермии и передаваться по наследству. Известно, что среди мужчин с бесплодием как мутации гена CFTR (кодирует специальный трансмембранный регуляторный белок муковисцидоза), так и 5Т-аллельный вариант гена CFTR встречаются в 1,5-2 раза чаще, чем в популяции [11]. Частота носительства для отдельных мутаций гена муковисцидоза у мужчин с бесплодием составляет 12%. Нами были выявлены следующие мутации в гене CFTR у мужчин: delF508 и 5Т(IVS8-5T), что составило 6,4% случаев.
В локусе AZF Y-хромосомы локализован ряд генов, участвующих в регуляции сперматогенеза. В литературе определена роль микроделеций AZF а,b или с в этиологии нарушения фертильности и сперматогенеза у мужчин с кариотипом 46,ХY, патозооспермией и бесплодием [12]. Частота микроделеций а,b,c AZF-локуса следующая: микроделеция в субрегионе AZF с – выявляется в 75-80% случаев; в субрегионах AZF b+с – 20-22%; в субрегионе AZF а – 3-5% случаев. При азооспермии выявлено 12-15% мужчин с микроделециями в локусе AZF, при менее тяжелой форме патологии сперматогенеза (олигозооспермии) – у 8-10% мужчин [5,12,13]. В нашем исследовании выявлено 3,2% микроделеций в субрегионе AZF с у мужчин с азооспермией.
Помимо AZF-региона хромосомы Y с бесплодием связан полиморфизм многочисленных групп генов сперматогенеза, локализованных в иных регионах других хромосом. В течение последних трех лет удалось определить связь с мужским бесплодием следующих генов: MTHFR, SHBG, Piwi, CYP19A1, НКО, GSTM1, Bcl2, ESR1, ESR2, TNP1, SOHLH1, EPPIN, GSTT1, TSSK6, TSSK2, MDR1, MSH5, MLH3, H2BFWT, PACRG и FASLG [14-25].
Ещё одним из факторов мужского бесплодия является нарушение гормональной регуляции сперматогенеза, ключевую роль в котором играют мужские половые гормоны – андрогены. Они взаимодействуют со специфическими андрогеновыми рецепторами, определяя развитие мужских половых признаков и активируя сперматогенез. Для гена андрогеновых рецепторов (AR) характерно наличие последовательности повторов CAG, количество которых может значительно варьировать (от 8 до 25). Показано, что увеличение количества CAG-повторов в рецепторах (>26) снижает их активность и может приводить к нарушению сперматогенеза. В нашем исследовании увеличение длины СAG-повтора в гене AR выявлено у двух пациентов (6,4%) с первичным бесплодием: у пациента с азооспермией (27(СAG)) и у пациента с астенозооспермией (27(СAG)).
Заключение
Таким образом, использование в диагностике молекулярно-генетических, молекулярно-цитогенетических методов значительно повышает частоту выявления нарушений репродуктивной функции генетической природы. Это следует учитывать при исследовании причин бесплодия в супружеских парах, особенно с идиопатическим бесплодием.
Результаты нашего исследования позволяют сделать следующие выводы:
В структуре бесплодного брака преобладает первичное бесплодие (до 77%).
При сочетанном бесплодии среди женских факторов на первом месте стоит трубно-перитонеальный фактор (до 43%), на втором месте – эндокринное бесплодие (до 30%), на третьем – эндометриоз (до 25%).
В структуре патозооспермии среди причин мужского бесплодия преобладает астенотератозооспермия (до 65%).
Частота генетических нарушений в общей группе (608 человек) составила 1,3% (хромосомная патология); при дополнительном молекулярно-генетическом обследовании 31 мужчины с тяжёлыми формами патозооспермии, преимущественно с азооспермией, выявлено 5 случаев (16%) генных нарушений.
Современные методы вспомогательной репродукции помогают парам даже с тяжёлыми формами бесплодия, в том числе обусловленными генетическими факторами, в преодолении бесплодия. Однако специалистам необходимо четко понимать, с каким типом хромосомных аберраций они имеют дело. Пациент должен получить консультацию медицинского генетика о риске передачи потомству генетической патологии, имеющейся у родителя. В настоящее время в арсенале специалистов имеются такие методы вспомогательной репродукции, как экстракорпоральное оплодотворение (ЭКО), интрацитоплазматическая инъекция сперматозоида в яйцеклетку (ИКСИ, ИМСИ), извлечение сперматозоида из яичка (TESE), преимплантационная генетическая диагностика (ПГД). Все они в совокупности с клинико-генетическим обследованием и медико-генетическим консультированием помогают решить проблему деторождения и снизить риск передачи потомству генетических нарушений.
Литература:
1. Корнеева И.Е. Общая концепция диагностики и классификации форм бесплодия. Бесплодный брак. Современные подходы к диагностике и лечению: руководство. Под. ред. Г.Т. Сухих, Т.А. Назаренко. 2-е изд. испр. и доп. М.: ГЭОТАР-Медиа, 2010; 21-52.
2. Глинкина Ж.И., Леонов Б.В. и др. ПГД врождённых и наследственных заболеваний методом FISH в программе ЭКО и ПЭ. Лечение женского и мужского бесплодия. Вспомогательные репродуктивные технологии. Под. ред. В.И. Кулакова, Б.В. Леонова, Л.Н. Кузьмичева. М.: Медицинское информационное агентство, 2005; 162-197.
3. Черных В.Б., Курило Л.Ф. Комплексное молекулярно-генетическое обследование мужчин с бесплодием. Мужское здоровье и долголетие. Сборник материалов 5-го Российского научного Форума. 2007; 96.
4. Курило Л.Ф., Гордеева С.И. Типы хромосомных аномалий у пациентов с нарушением формирования и/или функции органов репродуктивной системы. Андрология и генитальная хирургия. 2009; 3: 24-28.
5. Shi Y.C., Cui Y.X., Wei L. et al. AZF microdeletions on the Y chromosome in infertile Chinese men: a five-year retrospective analysis. Zhonghua Nan Ke Xue. 2010; 16: 9.
6. Курило Л.Ф., Сорокина Т.М., Черных В.Б. и др. Структура генетически обусловленных заболеваний органов репродуктивной системы. Андрология и генитальная хирургия. 2011; 3: 17-26.
7. Poongothai J., Gopenath T. S., Manonayaki S. Genetics of human male infertility. Singapore Med J. 2009; 4: 336-347.
8. Miyamoto T., Tsujimura A., Miyagawa Y., et al. Male Infertility and Its Causes in Human. Advances in Urology. 2012; 7: 8.
9. Starke H., Seidel J., Henn W. et al. Homologous sequences at human chromosome 9 bands p12 and q13-21.1 are involved in different patterns of pericentric rearrangements. European Journal of Human Genetics, 2002; 10: 790-800.
10. Hofherr S., Wiktor A., Kipp B., Dawson D., Van Dyke D. Clinical diagnostic testing for the cytogenetic and molecular causes of male infertility: the Mayo Clinic experience. Journal of Assisted Reproduction and Genetics. 2011; 8: 1091-1098.
11. Черных В.Б. Микроделеции Y-хромосомы и мутации гена CFTR как причина бесплодия у мужчин: Сб. Молекулярно-биологические технологии в медицинской практике. Новосибирск: Альфа-Виста Н. 2008; 12: 119-126.
12. Черных В.Б., Чухрова А.Л., Бескоровайная Т.С. и др. Частота и типы делеций Y-хромосомы при бесплодии у мужчин. Генетика. 2006; 8: 1-6.
13. Cai ZM. Y chromosome microdeletion and male infertility: past, present and future. Zhonghua Nan Ke Xue. 2010; 16(5): 94.
14. Safarinejad M., Shafiei N., Safarinejad S. Relationship between genetic polymorphisms of methylenetetra-hydrofolate reductase (C677T, A1298C, and G1793A) as risk factors for idiopathic male infertility. Reproductive Sciences. 2011; 3: 304-315.
15. Safarinejad M., Shafiei N., and Safarinejad S. Association of the (TAAAA)n repeat and Asp327Asn polymorphisms in the sex hormonebinding globulin (SHBG) gene with idiopathic male infertility and relation to serum SHBG concentrations. Journal of Steroid Biochemistry and Molecular Biology. 2011; 1: 37-45.
16. Gu A., Ji G., Shi X. et al. Genetic variants in Piwiinteracting RNA pathway genes confer susceptibility to spermatogenic failure in a Chinese population. Human Reproduction. 2010; 12: 2955-2961.
17. Hammoud A., Griffin J., Meikle A., Gibson M. et al. Association of aromatase (TTTAn) repeat polymorphism length and the relationship between obesity and decreased sperm concentration. Human Reproduction. 2010; 12: 3146–3151.
18. Gu A., Ji G., Zhou Y. et al. Polymorphisms of nucleotide-excision repair genes may contribute to sperm DNA fragmentation and male infertility. Reproductive BioMedicine Online. 2010; 5: 602–609.
19. Vani G., Mukesh N., Prasad B. et al. Role of glutathione S-transferase Mu-1 (GSTM1) polymorphism in oligospermic infertile males. Andrologia. 2010; 4: 213–217.
20. Safarinejad M., Shafiei N., Safarinejad S. Association of polymorphisms in the estrogen receptors , and (ESR1, ESR2) with the occurrence of male infertility and semen parameters. Journal of Steroid Biochemistry and Molecular Biology. 2010; 4: 193–203.
21. Choi Y., Jeon S., Choi M. et al. Mutations in SOHLH1 gene associate with nonobstructive azoospermia. Human Mutation. 2010; 7: 788–793.
22. Safarinejad M., Shafiei N., Safarinejad S. The association of glutathione-S-transferase gene polymorphisms (GSTM1, GSTT1, GSTP1) with idiopathic male infertility. Journal of Human Genetics. 2010; 9: 565–570.
23. Ding X., Zhang J., Fei J. et al. Variants of the EPPIN gene affect the risk of idiopathic male infertility in the Han-Chinese population. Human Reproduction. 2010; 7;1657–1665.
24. Zhang H., Su D., Yang Y. et al. Some singlenucleotide polymorphisms of the TSSK2 gene may be associated with human spermatogenesis impairment. Journal of Andrology. 2010; 4: 388-392.
25. Wang W., Lu N., Xia Y. et al. FAS and FASLG polymorphisms and susceptibility to idiopathic azoospermia or severe oligozoospermia. Reproductive BioMedicine Online. 2009; 1: 141-147.
MEDICO-GENETIC ASPECTS OF INFERTILITY
Goncharova N.N.1, Martyshkina E.Yu.1, Kaznacheyeva T.V.1, Arslanyan K.N.1, Adamyan L.V.1, Kurilo L.F.2, Sorokina T.M.2, Chernych V.B.2
1 Chair of Reproductive Medicine and Surgery, Faculty of Postgraduate Education MSMSU
2 Medicogenetic Scientific Center, Russian Academy of Medical Science (Moscow)
Abstract: results of medico-genetic examination of 304 married couples with infertility (608 individuals) are presented in article. Frequency of genetic abnormalities and infertility structure are revealed. Comparative analysis between 2 groups of couples with male as well as combined infertility is performed. The groups were formed according the results of infertility treatment using methods of ART. The factors having had statistically significant impact on fertility were revealed.
Key words: infertility, male infertility, combined infertility, cytogenetic analysis, molecular-genetic analysis, chromosomal abnormalities, chromosome variants, ART. |
|