Флюоресцентная диагностика в мониторинге за поведением самостоятельной гормонотерапии у пациенток с предраком и раком эндометрия.
Чулкова О.В.1, Филоненко Е.В.1, Серова Л.Г.2, Макарова И.И.3 Дата публикации на сайте: 2012-01-14 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Проанализированы результаты флюоресцентной диагностики в мониторинге за проведением самостоятельной гормонотерапии с препаратом «Аласенс» (3% раствор, 10 мл в полость матки) у 53 пациенток репродуктивного возраста с предраком и раком эндометрия. Время экспозиции Аласенса составило 2 часа. Флюоресцентная диагностика была выполнена у данной когорты больных на различных этапах лечения: онкологического, восстановительного, а также через год после окончания гормонального лечения. На основании сопоставления данных флюоресцентного и морфологического исследований диагностирован ранний рецидив и неизлеченность процесса у 9 (16,9%) из 53 пациенток.
Ключевые слова: Аласенс, флюоресцентная диагностика, спектрофлуорометрия, самостоятельная гормонотерапия, предрак эндрометрия, рак эндометрия
1 Московский научно-исследовательский онкологический институт им П.А. Герцена
2 Кафедра акушерства и гинекологии МФ РГМУ им Н.И. Пирогова, Москва
3 Кафедра акушерства и гинекологии ФППОВ, Первый Московский Государственный Медицинский Университет им. И.М. Сеченова, Москва
Введение
Злокачественные новообразования – актуальная проблема современности. Распознавание и лечение ранних форм рака предупреждают запущенность онкологического процесса и способствуют снижению смертности от него, что является не только медико-биологической, но и важной социальной задачей [1].
В России, как и в большинстве стран мира, отмечается отчетливая тенденция к увеличению роста заболеваемости раком тела матки. На сегодняшний день рак эндометрия (РЭ) занимает первое место среди злокачественных опухолей женских половых органов и составляет 24,2% [6].
Представление о раке эндометрия как о болезни женщин пожилого возраста постепенно меняется. Доля заболевших в пременопаузальном и репродуктивном возрасте составляет 40% женщин. Таким образом, РЭ является такой же актуальной проблемой у молодых, как и у пациенток старшей возрастной группы, в связи с чем наиболее перспективным направлением является диагностика ранних форм рака и проведение органо-сохраняюших видов лечения [5].
Больные репродуктивного возраста, страдающие предраком и начальным раком эндометрия наиболее часто обращаются к гинекологам или эндокринологам женской консультации, а не к онкологам, в связи с отсутствием патогномоничных признаков заболевания [3].
Основными причинами обращения становятся нарушения менструального цикла, первичное и вторичное бесплодие, что может свидетельствовать о различных нарушениях репродуктивной системы, маскируя при этом онкологический процесс.
Отсутствие онкологической настороженности у врачей общей лечебной сети и недооценка возможного наличия опухолевого процесса у молодых пациенток часто приводит к ошибкам на диагностическом этапе [8].
Диагностика рака эндометрия должна быть эффективной уже во время первых обследований. В настоящее время приоритетным направлением развития науки является разработка и внедрение высокотехнологичных методов ранней диагностики предрака и рака тела матки, основанных на использовании последних достижений медицинских технологий.
Среди них наиболее перспективными в настоящее время считаются флюоресцентные методы. Флюоресцентная диагностика (ФД) позволяет обнаружить опухоли размером до 1 мм, локализующиеся на слизистой оболочке [7].
В настоящее время создана и внедряется в клиническую практику флюоресцентная эндоскопическая аппаратура, использующая экзогенные и эндогенные (индуцированные 5-аминолевулиновой кислотой) опухолетропные фотосенсибилизаторы (фотогем, фотосенс, протопорфирин IX), позволяющая визуально наблюдать очаги флюоресценции в зоне предопухолевого и опухолевого процесса, уточнять границы поражения, что дает возможность расширить исследования онкогинекологов. На данный момент большие перспективы специалисты связывают с 5-аминолевулиновой кислотой (5-АЛК, препарат «Аласенс», производитель ГНЦ НИОПИК, Россия). Во-первых, она представлена практически во всех клетках человека как промежуточный продукт синтеза гема. Во-вторых, 5-АЛК является не фотосенсибилизатором, а метаболическим стимулятором синтеза эндогенного протопорфирина IX. Введение экзогенной 5-АЛК вызывает повышенное, селективное накопление протопорфирина IX в опухолевой ткани и визуализируется в виде характерной красной флюоресценции, которую можно наблюдать в синем свете. Это позволяет визуально определять границы новообразований и количество участков поражения, выполнять прицельную биопсию. На чем и основан метод флюоресцентной диагностики с 5-АЛК [7; 9; 10; 11; 12].
В последнее десятилетие концепция щадящих и органосохраняющих методов лечения гормонозависимых опухолей у пациенток репродуктивного возраста получила убедительные клинические доказательства обоснованности данной терапии при заболеваниях женской половой сферы. Уникальным примером такого воздействия является гормональное лечение атипической гиперплазии эндометрия и начального рака тела матки с помощью прогестагенов [2,5].
В МНИОИ им П.А. Герцена проведена диагностическая флюоресцентная гистероскопия 53 пациенткам в качестве мониторинга за проводимой самостоятельной гормонотерапией, с ранее установленными диагнозами атипическая гиперплазия эндометрия (n=17) и начального рака тела матки (n=36) с препаратом «Аласенс».
Аласенс в виде раствора (3% – 10 мл), приготовленный непосредственно перед исследованием, вводится в полость матки. Временной интервал для флюоресцентной диагностики составил 1,5–2 часа. При введении Аласенса аллергических реакций не отмечено. После этого, под общим кратковременным внутривенным наркозом проводится гистероскопия с использованием аппаратуры немецкой системы D-Light («Karl Storz») для визуального изучения изображения в белом свете, режиме 5-АЛК – индуцированной флуоресценции ППIX при возбуждении синим светом (380-440 нм).
Для морфологической верификации диагноза у пациенток выполняли прицельную биопсию из следующих зон: 1) участков подозрительных на опухолевое поражение в белом свете; 2) неизмененных участков эндометрия при осмотре в белом свете; 3) флюоресцирующих участков эндометрия при проведении ФД; 4) из нефлюоресцирующих участков эндометрия в режиме флюоресценции.
Для маркировки очаговых образований эндометрия, выявляемых в процессе проведения флюоресцентной гистероскопии, была применена классификация, разработанная в МНИОИ им П.А. Герцена [22]: V (+) – опухоль определяется визуально при осмотре в белом свете, V (-) – опухоль при осмотре в белом свете не определяется, F (+) – очаг флюоресценции, F (-) – флюоресценция не определяется.
ФД была выполнена на различных этапах проведения самостоятельной гормонотерапии: на тест-дозе препарата, по окончании онкологического этапа лечения и восстановительного этапа, а также через год после окончания гормонального лечения.
Цель исследования
Целью исследования явилась оценка результатов флюоресцентной гистероскопии при проведении гормонального лечения и определение эффективности и возможности применения флюоресцентной гистероскопии на этапах самостоятельной гормонотерпапии.
Онкологический этап лечения включал в себя прием высоких доз прогестерона (в данном исследовании в качестве терапевтического агента применялся медроксипрогестерона ацетат (Провера) таблетированная форма), а восстановительный этап был направлен на восстановление функциональной способности эндометрия после лечения путем приема комбинированного эстроген-гестагенного препарата (Ригевидона) по контрацептивной схеме.
Флюоресцентная гистероскопия у 15 (28,3%) из 53 пациенток выполнена на этапе тест-дозы препарата. Из них у 6 пациенток с клиническим диагнозом АГЭ эта доза составила 15 г и у 9 больных с РЭ – 30 г.
Гистероскопическая картина в режиме «белого света» выглядела следующим образом: поверхность слизистой неровная, несколько утолщена, преимущественно бледно-розового цвета, выводные протоки желез расширены, устья маточных труб визуализированы.
Во флюоресцентном режиме отмечали наличие очагов флюоресценции в области маточных углов.
Всего было взято 70 биоптатов: 40 – из участков флюоресценции и 30 – из нефлюоресцирующих зон. По данным морфологического исследования в 24 из 40 участков флюоресценции диагностирована АГЭ (дисплазия III ст), а в 16 – децидуоподобная реакция стромы. Во всех 30 биоптатах из нефлюоресцирующих зон эндометрий неизменен.
Определение эффективности флюоресцентной гистероскопии проводили в сопоставлении с данными планового морфологического исследования (табл. 1).
Таблица 1. Сопоставление результатов стандартной, флюоресцентной гистероскопии и гистологического исследования у пациенток на этапе тест-дозы препарата провера.
| Данные морфологического исследования | Визуальная оценка эндометрия | Всего биоптатов | | V(+)F(+) | V(-)F(+) | V(-)F(-) | | Т(+) | 20 (5б-х) | 4 (2б-х) | - | 24 | | Т(-) | 16 (8б-х) | - | 30(15б-х) | 46 | | ВСЕГО | 36 | 4 | 30 | 70 |
Т (+) – опухоль эндометрия по данным морфологического исследования, Т (-) – опухоль эндометрия по данным морфологического исследования не определяется, V (+) – опухоль определяется визуально при осмотре в белом свете,V (-) -при стандартной гистероскопии нет данных за опухоль, F (+) – очаг флюоресценции, F (-) – флюоресценции нет.
Таким образом, по результатам морфологического исследования биоптатов эндометрия количество истинноположительных (наличие атипической гиперплазии эндометрия (дисплазии III ст) результатов флюоресцентной диагностики составило 24, истинно-отрицательных (отсутствие патологии эндометрия) – 30, ложноотрицательных результатов не было, ложно-положительных (наличие флюоресценции очагов с децидуоподобной реакцией стромы) – 16. Данное изменение эндометрия отмечается при воздействии на слизистую гормонального препарата, содержащего прогестерон и свидетельствует о выраженном лекарственном патоморфозе. Проявляется децидуоподобная реакция трансформацией и отеком стромы с наличием в последней лимфоцитов, относительно многочисленных капилляров с признаками нарушения сосудистой проницаемости и железистого эпителия без признаков функциональной активности.
Чувствительность метода ФД в группе больных на тест-дозе препарата Провера составила 99%, специфичность – 65%. Диагностическая точность метода – 60,6%.
Флюоресцентная диагностика выполнена у 20 (37,7%) из 53 пациенток после окончания онкологического этапа лечения. Из них у 5 пациенток с АГЭ доза препарата составила 30 г и у 15 больных с РЭ – 60–70 г.
При гистероскопической картине в режиме «белого света» визуализировалась полная атрофия эндометрия – слизистая оболочка тонкая, бледная, устья маточных труб хорошо визуализировались (рис. 1).
 | Рисунок 1. Эндометрий в режиме «белого света». |
При проведении ФД – флюоресценции не определялось (рис. 2).
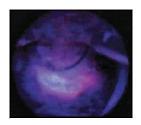 | Рисунок 2. Эндометрий в режиме «флюоресценции». |
С целью морфологической верификации диагноза у 20 пациенток было взято 22 биоптата из макроскопически неизмененных в белом свете и нефлюоресцирующих участков слизистой полости матки. По данным морфологического исследования во всех биоптатах диагностирована атрофия эндометрия (табл. 2).
Таблица 2. Сопоставление данных стандартной, флюоресцентной гистероскопии и гистологического исследования у пациенток после окончания онкологического этапа.
| Данные морфологического исследования | Визуальная оценка эндометрия | Количество биоптатов | | V(+)F(+) | V(-)F(+) | V(-)F(-) | | Т(+) | - | - | - | - | | Т(-) | - | - | 22 (20б-х) | 22 | | Итого | | | | 22 |
Т (+) – опухоль эндометрия по данным морфологического исследования, Т (-) – опухоль эндометрия по данным морфологического исследования не определяется, V (+) – опухоль определяется при осмотре в белом свете, V (-) – при стандартной гистероскопии нет данных за опухоль, F (+) – очаг флюоресценции, F (-) – флюоресценции нет.
Таким образом, количество истинноотрицательных (отсутствие патологии эндометрия) результатов ФД было 22, истинноположительных, ложноположительных и ложноотрицательных результатов не получено.
Чувствительность, специфичность и диагностическая точность метода после онкологического этапа лечения составила 99%.
После окончания восстановительного этапа лечения (эстраген-гестагенными препаратами) у 13 (24,5%) с атипической гиперплазией эндометрия (дисплазия III ст) (3 пациентки) и раком эндометрия (10 пациентов) из 53 больных произведена контрольная флюоресцентная гистероскопия.
Гистероскопическая картина в режиме «белого света» была представлена бледно-розовой, равномерно утолщенной слизистой полости матки с визуализацией устьев маточных труб.
При гистероскопической картине эндометрия в режиме флюоресценцентного исследования отмечались очаги флюоресценции у 5 пациенток с клиническим диагнозом РЭ в области маточных труб ярко-красного или бледно-розового цвета, у остальных 8 больных флюоресцирующие очаги не были выявлены.
Всего было взято 36 биоптатов: 10 – из очагов флюоресценции и 26 – из нефлюоресцирующих зон. В 4 из 10 флюоресцирующих очагов по данным морфологического исследования диагностирован рак эндометрия, в 6 – дисплазия I-II ст. Во всех 26 биоптатах из нефлюоресцирующих зон – нормальный эндометрий (табл. 3).
Таблица 3. Сопоставление данных стандартной, флюоресцентной гистероскопии и гистологического исследования у пациенток после восстановительного этапа лечения.
| Данные морфологического исследования | Визуальная оценка эндометрия | Количество биоптатов | | V(+)F(+) | V(-)F(+) | V(-)F(-) | | Т(+) | - | 4 (2б-х) | - | 4 | | Т(-) | - | 6 (3б-х) | 26 (13б-х) | 32 | | Итого | | 10 | 26 | 36 |
Т (+) – опухоль эндометрия по данным морфологического исследования, Т (-) – опухоль эндометрия по данным морфологического исследования не определяется, V (+) – опухоль определяется при осмотре в белом свете,V (-) – при стандартной гистероскопии нет данных за опухоль, F (+) – очаг флюоресценции, F (-) – флюоресценции нет.
По результатам морфологического исследования биоптатов эндометрия количество истинноположительных результатов (наличие флюоресценции рака эндометрия) составило 4, которые были диагностированны только на основании проведения ФД; истинно-отрицательных (отсутствие флюоресценции нормального эндометрия) – 26; ложноположительных (наличие флюоресценции очагов дисплазии I-II) – 6; ложно-отрицательных результатов не было отмечено.
Чувствительность метода ФД с препаратом «Аласенс» в группе больных после восстановительного этапа лечения составила 99%, специфичность – 90%, диагностическая точность метода – 90%.
Таким образом, только на основании проведения флюоресцентной диагностики на данном этапе самостоятельной гормонотерапии выявлена неизлеченность рака эндометрия у 5 пациенток. У 2 женщин – выявлены очаги рака эндометрия и им впоследствии выполнена аблация эндометрия, у 3 пациенток – дисплазия I и II степени и у них было продолжено проведение самостоятельной гормонотерапии.
Флюоресцентная диагностика была выполнена у 5 (9,4%) из 53 пациенток через один год после окончания самостоятельной гормонотерапии; из них: 3 пациентки с АГЭ (дисплазии III ст) и 2 больные с РЭ.
Гистероскопическая картина в режиме «белого света» у одной пациентки была представлена бледно-розовым, равномерно утолщенным эндометрием с визуализацией устьев маточных труб и у 4 пациенток было выявлено утолщение слизистой полости матки в виде полиповидных образований в области устьев маточных труб.
Гистероскопическая картина эндометрия во флюоресцентном режиме характеризовалась наличием очагов флюоресценции по боковым стенкам и в области маточных углов.
Всего было взято 18 биоптатов у 5 пациенток: 8 – из очагов флюоресценции и 10 – из нефлюоресцирующих зон. По данным морфологического исследования в 4 из 8 флюоресцирующих участков был диагностирован рак эндометрия, в других 4 – дисплазия I-II степени. Во всех биоптатах из нефлюоресцирующих зон – неизмененный эндометрий (табл. 4).
Таблица 4. Сопоставление результатов стандартной, флюоресцентной гистероскопии и гистологического исследования у пациенток через 1 год после лечения.
| Данные морфологического исследования | Визуальная оценка эндометрия | Количество биоптатов | | V(+)F(+) | V(-)F(+) | V(-)F(-) | | Т(+) | - | 4 (2б-х) | - | 4 | | Т(-) | - | 4 (2б-х) | 10 (5б-х) | 14 | | Итого | | 8 | 10 | 18 |
Т (+) – опухоль эндометрия по данным морфологического исследования, Т (-) – опухоль эндометрия по данным морфологического исследования не определяется, V (+) – опухоль определяется при осмотре в белом свете, V (-) – при стандартной гистероскопии нет данных за опухоль, F (+) – очаг флюоресценции, F (-) – флюоресценции нет.
По результатам морфологического исследования биоптатов эндометрия количество истинно-положительных (наличие флюоресценции рака эндометрия) результатов ФД составило 4, которые были диагностированы только на основании проведения ФД; истинно-отрицательных (отсутствие флюоресценции нормального эндометрия) – 10; ложно-положительных (флюоресценция очагов дисплазии I-II) – 4; ложно-отрицательных результатов получено не было.
Чувствительность метода ФД с препаратом «Аласенс» в группе больных через 1 год после окончания самостоятельной гормонотерапии составила 99%, специфичность – 83%, диагностическая точность метода – 86%.
Таким образом, только на основании проведения флюоресцентной гистероскопии был зафиксирован рецидив заболевания у 4 пациенток.
У 2 женщин с клиническим диагнозом атипическая гиперплазия эндометрия выявлены очаги дисплазии I-II степени. С целью предотвращения развития предопухолевой или опухолевой патологии эндометрия пациенткам было рекомендовано гормональное лечение прогестагенами во вторую фазу менструального цикла под строгим динамическим наблюдением. У 2 пациенток, получавших лечение по поводу начального рака эндометрия, диагностирован рецидив заболевания и им проведено хирургическое лечение.
В качестве иллюстрации приводим следующее наблюдение.
Пациентке Л., 30 лет в МНИОИ им П.А. Герцена с 2006 по 2007 г. проводилась самостоятельная гормонотерапия, в качестве органосохраняющего метода лечения по поводу рака эндометрия Ia стадии (T1aN0M0). Излечение зафиксировано в феврале 2007 г.
В феврале 2008 г. (через год после окончания лечения) пациентка обратилась к гинекологу по м/ж с жалобами на нарушение менструального цикла с периодическими маточными кровотечениями. По м/ж выполнено РДВ под контролем гистероскопии. Эндоскопически патологических участков в полости матки не обнаружено и по данным морфологического исследования в соскобе из полости матки – железистая гиперплазия эндометрия. Назначено гормональное лечение во вторую фазу менструального цикла в течение 6 мес.
В сентябре 2008 г. пациентка поступила в МНИОИ им П.А. Герцена с жалобами на мажущие кровянистые выделения после менструации. По данным УЗИ органов малого таза (6 день менструального цикла): матка нечетких, ровных контуров, 55х47х52 мм. М-эхо 12 мм, структура неоднородная, с гиперэхогенными точечными включениями. При ЦДК кровоток в маточных артериях не определялся. Яичники без структурных изменений.
26.11.2008 г. выполнена флюоресцентная диагностика эндометрия с прицельной биопсией и раздельным диагностическим выскабливанием.
Эндоскопически: в режиме «белого света» – полость матки не деформирована, слизистая утолщена, складчатая, бледно-розовая, устья маточных труб не визуализировались. Во флюоресцентном режиме отмечалась флюоресценция в виде ярко – розового свечения в области левого трубного угла с переходом на левую боковую стенку.
По данным морфологического исследования № П3242: во флюоресцирующем участке из полости матки на фоне простой и комплексной ЖГЭ небольшие участки высокодифференцированной эндометриальной аденокарциномы. По данным РДВ: в соскобе из полости матки – простая и комплексная железистая гиперплазия эндометрия.
Таким образом, только на основании проведения ФД с прицельной биопсией у пациентки диагностирован ранний рецидив заболевания, что не было выявлено по данным РДВ. Пациентке вновь была начата самостоятельная гормонотерапия, учитывая желание женщины сохранить репродуктивную функцию и молодой возраст.
Проанализировав результаты проведения флюоресцентной диагностики у 53 (34,4%) больных, проходящих лечение по поводу атипической гиперплазии (дисплазия III ст) и рака эндометрия, была оценена эффективность проведения ФД на различных этапах самостоятельной гормонотерапии. Проведение ФД после онкологического, восстановительного лечения, а также спустя один год после показало высокую эффективность данного метода. Учитывая большое количество ложноположительных результатов и в связи с этим низкую специфичность и диагностическую точность метода, сочтено целесообразным на данном этапе лечения флюоресцентную гистероскопию не проводить.
В заключение следует отметить, что выполнение флюоресцентной диагностики с визуальной оценкой флюоресцирующего изображения и прицельной биопсией эндометрия в значительной степени повышает выявление ранних рецидивов или неизлеченности от онкологического процесса на фоне и после проведения самостоятельной гормонотерапии.
Литература:
1. Ашрафян Л.А., Харченко Н.В., Огрызкова В.Л. Современные принципы первичной и уточняющей диагностики рака эндометрия//Практическая онкология. – 2004. –Т. 5. № 1. – С. 16-24.
2. Берштейн Л.М., Эпидемиология, патогенез и пути профилактики рака эндометрия: стабильность или эволюция?// Практическая онкология. 2004. Т. 5. № 1. С. 1-8.
3. Бохман Я.В. // Руководство по онкогинекологии. СПб.: Фолиант, 2002. – С. 56-58, 309-330.
4. Лукин В.В. Лапароскопическая флуоресцентная диагностика перитонеальной диссеминации злокачественных новообразований: Автореф. дис. М., 2010 г.
5. Новикова Е.Г., Чулкова О.В., Пронин С.М. Предрак и начальный рак эндометрия у женщин репродуктивного возраста. – М.: МИА, 2005. – 131 с.
6. Чиссов В.И., Старинский В.В. Основные показатели состояния онкологической помощи населению Российской Федерации в 2009 г. – М., 2009.
7. Чиссов В.И., Соколов В.В., Филоненко Е.В. Флюоресцентная эндоскопия, спекирофотометрия в диагностике злокачественных опухолей основных локализаций//Российский биотерапевтический журнал. 2003 г. № 4. – Т. 2. – С. 45-56.
8. Чиссов В.И., Трахтенберг А.Х. Ошибки в клинической онкологии. М., 1993 г.
9. Fehr MK. Wyss P.Tadir Y. Selective photosensitizer localization in the human endometrial afte intrauterine application of 5-aminolevulinic acid. Obstetrics Am J Obstet Gynecol 2003. Nov 175(5): 1253-9.
10. Lang K, Lehmann P, Bolsen K. Aminolevulinic acid pharmacological profile and clinical indication. Obstetrics Expert Opin Investig Drugs. 2001 Oct, 72(10): 829-37.
11. Nowis D, Makowski M, Legat M, Golab J. Direct tumor damage mechanisms of photodynamic therapy. Obstetrics Acta Biochim Pol. 2005, 52(2): 339-52.
12. Wyss P. Haller U. Berns MW. Accumulation of 5-aminolevulinic acid – induced protoporphyrin IX in normal and neoplastic human endometrial epithelial cell. Obstetrics Biochim Biohys Res Commum. 2006, Jul 25, 224(3):819-24.
FLUORESCENT DIAGNOSIS IN THE MONITORING OF SELF-ADMINISTERED HORMONAL THERAPY IN FEMALE PATIENTS WITH ENDOMETRIAL PRECANCER AND CANCER
Chulkova О.V.1, Filonenko Е.V.1, Serova L.G.2, Makarova I.I. 3
1 Moscow Scientific-Research Institute of Oncology named after P.A. Gertsen
2 Chair of Obstetrics and Gynaecology, Faculty of Medicine, Russian State Medical University named after N. I. Pirogov, Moscow
3 Chair of Obstetrics and Gynaecology, Faculty for Continuous Training and Postgraduate Education of Physicians, First Moscow State Medical University named after I. M. Sechenov
Abstract: The results of a fluorescent diagnosis programme in the monitoring of self-administered hormonal therapy using Alasens (3% solution – 10 ml injected into the uterine cavity) have been analyzed in 53 female patients of reproductive age with endometrial precancer or cancer. The time of exposition to Alasens was 2 hours. The fluorescent diagnostic procedure was carried out in this patient cohort at different stages of therapy: oncological and rehabilitative, as well as at one year after discontinuation of hormonal therapy. After comparing the fluorescent and morphological examination data, an early relapse or ongoing process was diagnosed in 9 (16,9%) out of 53 patients.
Key words: Alasens, fluorescent diagnosis, spectrofluorimetry, self-administered hormonal therapy, precancer, endometrial cancer |
|